Онош, 2010, 46(046)
Хоол судлал, хавдрын Чиглэлээр хийгдэж буй судалгааны ажил, хэвлэлийн тойм, нийтлэл /НELICOBACTER PYLORI БА ПРОБИОТИК/
( Намтар )
Абстракт
Summary
Helicobacter pylori infection, a highly prevalent pathogen, is a major cause of chronic gastritis and peptic ulcer and a risk factor for gastric malignancies. Antibiotics-based H. pylori eradication treatment is 90% effective. However, it is expensive and causes side effects and antibiotic resistance. Probiotics could present a low-cost, large-scale alternative solution to prevent or decrease.
Probiotics had an in vitro inhibitory effect on H. pylori.Studies showed an improvement of H. pylori gastritis and decrease in H. pylori density after administration of probiotics. The addition of probiotics to standard antibiotic treatment improved H. pylori eradication rates (81% vs. 71%, with combination treatment vs. H. pylori–eradication treatment alone;). Probiotic treatment reduced H. pylori therapy-associated side effects (incidence of side effects: 23% vs. 46%, with combination therapy vs. H. pylori–eradication treatment alone;). No study could demonstrate the eradication of H. pylori infection by probiotic treatment. So long-term intake of products containing probiotic strains of probiotics may have a favorable effect on H. pylori infection in humans, particularly by reducing the risk of developing disorders associated with high degrees of gastric inflammation.
H.pylori бол спирал, грамм сөрөг, микроаэрофиль ходоодны патоген. Өндөр хөгжилтэй орнуудын хүн амын 30-40 орчим хувьд, хөгжиж буй орнуудын хүн амын 70 орчим хувьд нь H.pylori-ийн халдвар бүртгэгдэж, дэлхийн хүн амын тал орчим хувь нь H.pylori-аар халдварлагдсан байгааг судлаачид мэдээлжээ. Манай орны хүн амын дунд H.pylori – ийн халдвар өндөр байгааг (Н.Бира 74.5%, Н.Туул 46.9%, Г.Отгонсүрэн 65-100%, О.Сэргэлэн 65.71%, Х.Оюунцэцэг 86.2%) нар судалгаагаараа тогтоосон байдаг. Удаан хугацааны турш үргэлжилсэн H.pylori-гийн халдвар нь ходоодны архаг үрэвсэлд хүргэдэг ба энэ нь ходоодны шархны гол шалтгаан болдог байна. Одоо үед H.pylori-гийн халдварыг устгах эмчилгээний сонголт нь антибиотик ба протоны шахуургыг дарангуйлах эмнээс бүрдсэн хослол эмчилгээ юм. Энэ дэглэм нь ойролцоогоор 90%-ийн үр нөлөөтэй боловч антибиотик тэсвэрт чанар үүсгэх болон үнэтэй мөн гаж нөлөөтэй зэрэг дутагдалтай талтай байна.
Пробиотик судлал нь сүүлийн жилүүдэд хамгийн их анхаарал татаж байгаа бөгөөд пробиотик бүтээгдэхүүний хэрэглээ улам бүр ихсэж байна. Пробиотик гэдэг нь харьцангуй шинэхэн нэршил бөгөөд “амьд” хэмээх агуулгатай ба хүн болон амьтны эрүүл мэндэд ашиг тустай амьд нянг илэрхийлдэг. Өнгөрсөн зуунд Оросын эрдэмтэн Е. Мечников хүнсэнд агуулагдаж буй зарим нянгаас биеийн нянгийн орчин хамаарах бөгөөд эдгээр ашигтай нянгийн тусламжтайгаар биед аюултай нянг өөрчилж болох тухай таамаглал дэвшүүлсэн. 1930 онд Японы эмч Minora Shirota гэдсэнд байх бактерууд нь өвчнөөс урьдчилан сэргийлдгийг тодорхойлсон. Хүний биед ашигтай нянд сүүн хүчлийн болон хөрөнгийн нянгууд ордог. Үүнээс хамгийн сайн судлагдсан нь сүүн хүчлийн бактер бөгөөд исгэлэн сүүн бүтээгдэхүүнд агуулагдах ба тараг, айраг, аарц, бяслаг зэргийг үйлдвэрлэхэд хэрэглэддэг гол бичил биетэн юм. Хүнсэнд агуулагдах пробиотик нян нь хоол боловсруулах замыг даван туулах, гэдэсний хананд өсөж үржих чадвартай байх ёстой. Сүүн хүчлийн нянгууд нь грамм эерэг, савханцар эсвэл кокк, спор үүсгэдэггүй, каталаз сөрөг, агааргүйтэн, хүчилтөрөгчид тэсвэртэй, эмгэгтөрөгч бус, нүүрс усны задралаар сүүн хүчил үүсгэдэг байна. Сүүн хүчлийн нянгаас хамгийн их судлагдаж танигдсан нь Lactobacillus (LAB) юм. Сүүн хүчлийн нянгууд нь гэдэсний хананд бэхлэгдэн органик хүчлүүд гарган, орчний рН-ийг хүчиллэг болгохын хамт өөрийн биеэс лактолин, ацидофиллин, ацидолин зэрэг антибиотик төстэй бодисууд ялгаруулах замаар эмгэгтөрүүлэгч нянгуудын үржлийг саатуулдаг ажээ. Үүнээс гадна гэдэсний гүрвэлзэх хөдөлгөөнийг нэмэгдүүлэх, хоолны шингэцийг сайжруулах, гэдэсний ялзралын процессийг зогсоох болон дархлаа сайжруулах зэрэг эмчилгээ сувилгааны өндөр идэвхтэй нөлөө үзүүлдэг. Пробиотик бүтээгдэхүүн нь хүний эрүүл мэндэд чухал үүрэг гүйцэтгэж байна. Үүнээс дурьдвал пробиотик бүтээгдэхүүнийг ходоод гэдэсний үрэвсэлт өвчин, суулгалт, дисбактериоз, хелокобактерийн ходоодны үрэвсэлт өвчин, хавдар, харшил, гиперлипидеми, элэгний өвчнүүд, шээс бэлгийн замын өвчнүүд болон бусад олон эмгэгүүдийн үед эмчилгээ болгон хэрэглэж байна. Эдгээр эмгэгээс H.pylori-ийн халдварын эсрэг in vitro нөхцөлд пробиотик хэрхэн дарангуйлах нөлөө үзүүлдгийг судлаачдын судалгааны ажлуудыг харьцуулан тайлбарлахыг зорилоо.
Үйлчлэлийн механизм
• Дархлааны бус механизм
Дархлааны бус хоригууд түүн дотроос ходоодны хүчилшил (рН), ходоодны салстын хориг зэрэг нь эмгэгтөрүүлэгч бактерийн эсрэг хамгийн анхны хамгаалалт болдог.
Нянгийн эсрэг бодисууд
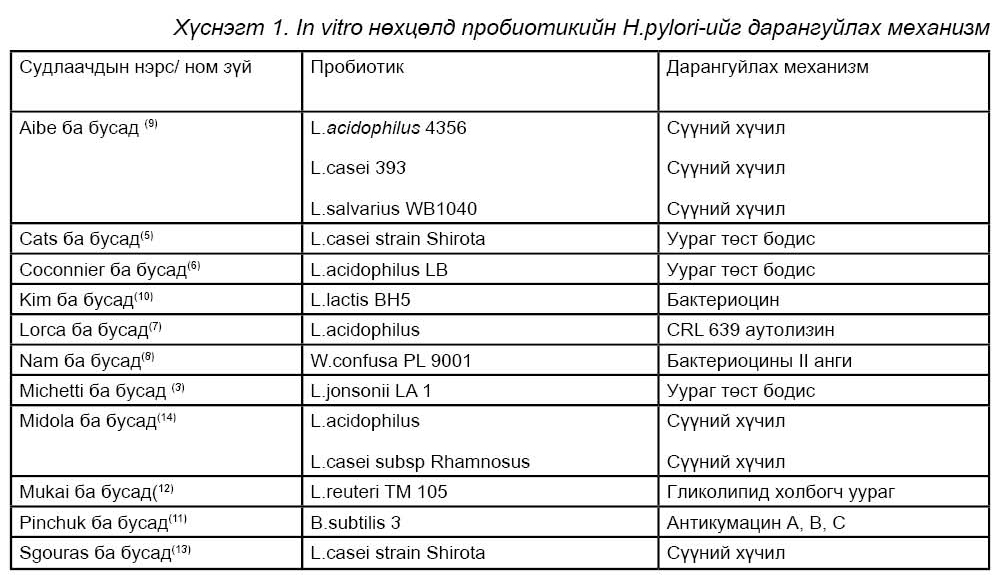
Пробиотикууд нь бактерийн эсрэг бодис ялгаруулж Н.pylori-н өсөлтийг дарангуйлдаг байж болох юм. Зарим LAB нь бактериоцин бүлтэй холбоотой микробын эсрэг нэгдлийг нийлэгжүүлдэг. (1,2). Энэ бактерийн ялгаруулдаг бусад бодисууд нь сүүний хүчлийн ферментүүд болох түүн дотроос сүүний хүчил, цууны хүчил болон устөрөгчийн хэт исэл зэрэг нь мэдэгдээд байна. Зарим судлаачдын үзэж байгаагаар Н.pylori-г дарангуйлагч хүчин зүйлд LAB-аас ялгарч байгаа лактат холбоотой гэдэг нь ихэнх хувийг эзэлж байна. (Хүснэгт1) Сүүний хүчил нь Н.pylori-н уреаз эсэгийг дарангуйлснаар орчны рН-ийг багасгасны дүнд нянгийн эсрэг үйл ажиллагааг үзүүлдэг байна. Гэсэн хэдий ч LAB-ын Н.pylori дээр үзүүлж байгаа дарангуйлах нөлөө нь омгоос омог бүрт харилцан адилгүй байгаа нь судлаачдын судалгаанаас харагдаж байна. Жишээлбэл: L.johnsonii La10 нь Н.pylori-ыг дарангуйлдаггүй боловч L.johnsonii La1-ийг бодвол сүүний хүчлийг ихээр ялгаруулдаг байна.(3) Бусад омгууд болох L.acidophilus LB, L.casei, L.johnsonii La1 ба L.lactis зэрэг нь Н.pylori дээр сүүний хүчил ба рН-тай холбоогүй механизмаар дарангуйлах нөлөө үзүүлдэг.(3,4-7) Бусад судлаачид нь энэхүү дарангуйлах нөлөө нь уураг төст нэгдэлтэй холбоотой гэж үздэг. Эдгээр омгууд нь бактерийн эсрэг бодис ялгаруулдгийг тодорхойлсон байна. Бусад пробиотик дотроос Weissella confuse(8) L.lactis (10) ба bacillus subtiles (11) зэрэг нь бакериоцин ялгаруулж Н.pylori-гийн өсөлтийг in vitro орчинд дарангуйлах чадвартай байгаа нь хүснэгтээс харагдаж байна. B.subtilis нь изокумарины төрлийн антибиотикт хамаарагддаг анимокумацинтай адилхан бодис ялгаруулдаг онцлогтой.
Наалдалтын өрсөлдөөн
H.pylori –ийн наалдуулагч хүчин зүйл нь хучуур эсийн салс ялгаруулагч гадаргууд орших хүлээн авагчтай холбогдон хучуур эсийг гэмтээснээр H.pylori холбоот өвчнүүдийг үүсгэдэг. In vitro судалгаануудад L. johnsonii La1, L. salivarius, L. acidophilus болон W. confuse зэрэг нь гэдэсний HT 29 эсэд мөн ходоодны MKN 45 эсэд H.pylori наалдахыг дарангуйлдаг гэдэгийг тодорхойлсон байдаг. (3,6) Эдгээр пробиотикууд нь өөр өөр механизмаар H.pylori наалдах идэвхийг дарангуйлдаг байна. Жишээлбэл: L. johnsonii La1 (3) ба L. acidophilus LB (5) зэрэг нь наалдалтын эсрэг идэвхтэй бактерийн эсрэг бодис ялгаруулдаг байхад L. reuteri ба W. confuse нь H.pylori наалдах хэсэгт нь өрсөн холбогддог байна.(8,12)
Салстын хориг
H.pylori-гийн шалтгаант ходоодны үрэвслийн үед хучуур эсийн пролифераци болон гэмтэл нь салстын ялгаралт буурснаас болдог байна. H.pylori нь хүний ходоодны эсийн MUCI болон MUC5A генийн экспрессийг дарангуйлдаг. Зарим in vitro судалгаануудад L.plantarum ба L.rhamnosus нь MUC2 ба MUC3 генийн экспрессийг нэмэгдүүлдэг ба бүдүүн гэдэсний эсийн өсгөвөр дээр эсийн гаднах муцины ялгаралтыг нэмэгдүүлж байсан нь тодорхойлогдсон.(15)
• Дархлааны механизм
H.pylori-гийн халдварын үед янз бүрийн үрэвслийн медиаторууд түүн дотроо хемокин болон цитокин зэргийг ялгаруулснаар үрэвслийн хариу урвал явагддаг. Цитокины хариу урвал нь интерлейкин-8 (IL-8) ялгарсантай холбоотой гэдэг нь нэгэнт батлагдсан байдаг бөгөөд IL-8 нь нейтрофил, моноцит эсийн нүүн шилжилтэнд оролцдог.(16) Идэвхжсэн моноцит болон сэртэнт эсүүд нь lamina propria-д хавдар үхжүүлэгч хүчин зүйл-α (TNF-α), IL-1 ба IL-6 зэргийг ялгаруулна(17). IL-1 ба IL-6 нь CD4+T эсийг идэвхжүүлснээр олон янзын цитокин түүн дотроо IL-4, IL-5, IL-6 мөн INF-γ зэргийг ялгаруулна.(18) Энэхүү хариу урвалын дүнд халдварын процесс идэвхгүй болдог байна. Пробиотик нь магадгүй дархлааны хариу урвалыг өөрчлөх замаар хучуур эсийн харилцан үйлчлэл мөн үрэвслийн эсрэг цитокины ялгаралтыг өөрчилснөөр ходоодны үрэвслийг багасгах идэвхийг үзүүлж байж болох юм. Мөн пробиотик нь хэсэг газрын Ig A-ийн ялгаралтыг нэмэгдүүлснээр салстын хоригийг хүчтэй болгон салст тотворжуулах нөлөө үзүүлж байдаг гэсэн судалгаа мөн байдаг(19).
Хэдийгээр пробиотикийн дархлааны механизмын талаарх олон янзын судалгаа байгаа боловч эдгээрийг нэгтгэн дүгнэхэд хэцүү байна. Учир нь сүүн хүчлийн нянгуудын олон омгууд байхаас гадна эзэн биеийн дархлааны байдлаас шалтгаалаад дархлааны хариу урвалыг өрнүүлэх хэлбэр нь ялгаатай байна.
Дээрх судлаачдын судалгааны ажлууд нь in vitro нөхцөлд Н.Pylori-ийг пробиотикууд дарангуйлдаг гэдгийг бүгд баталсан байгаа нь пробиотикийг Н.Pylori-ийн шалтгаант ходоодны үрэвслийн үед хэрэглэх боломжтойг харуулж байна. Пробиотик бүтээгдэхүүнийг уулгаж хэрэглэхдээ ихэвчлэн исгэлэн сүүн бүтээгдэхүүнийг нянгийн цэвэр өсгөврөөр баяжуулсан тараг, сүүг ихэвчлэн хэрэглэж байна. Эмчилгээний үр дүнг хянахдаа амьсгалын уреаз тестийг ихэнх судалгаан дээр ашиглажээ. Хэдийгээр пробиотик сүүн хүчлийн нянгууд нь H.pylori-ийг дарангуйлж байгаа боловч дангаар нь ууж хэрэглэхэд H.pylori-г устгах эмчилгээний үр дүн өгч чаддаггүй байна. Харин стандарт гурвал эмчилгээн дээр пробиотикийг уулгаж хэрэглэх нь эмчилгээний үр дүнтэй байна. Стандарт антибиотик эмчилгээний үр дүн 71% байхад пробиотиктой хавсарсан эмчилгээний үр дүн 81% байна.(20) Үүнээс гадна антибиотик эмчилгээний гаж нөлөө болох дисбиоз болон суулгалт нь дан антибиотик эмчилгээний үед 46% байсан бол пробиотиктай хавсарсан эмчилгээний үед 23% болж буурдаг байна. Дээрх судалгаануудын үр дүнгээс харахад H.pylori-г устгах эмчилгээнд пробиотик бүтээгдэхүүнийг хэрэглэж болохыг харуулахын зэрэгцээ энэ талын судалгаа манай оронд хийгдэх шаардлагатай байна.
Ном зүй
Ном зүй
1. Jack RW, Tagg JR, Ray B. Bacteriocins of gram-positive bacteria. Microbiol Rev. 1995;59:171–200.
2. Klaenhammer TR. Genetics of bacteriocins produced by lactic acid bacteria. FEMS Microbiol Rev. 1993;12:39–85.
3. Michetti P, Dorta G, Wiesel PH, Brassart D, Verdu E, Herranz M, FelleyC, Porta N, Rouvet M, et al. Effect of whey-based culture supernatant of Lactobacillus acidophilus (johnsonii) La1 on Helicobacter pylori infection in humans. Digestion. 1999;60:203–9
4. Bernet-Camard MF, Lievin V, Brassart D, Neeser JR, Servin AL, Hudault S. The human Lactobacillus acidophilus strain LA1 secretes a nonbacteriocin antibacterial substance(s) active in vitro and in vivo. Appl Environ Microbiol. 1997;63:2747–53.
5. Cats A, Kuipers EJ, Bosschaert MA, Pot RG, Vandenbroucke-GraulsCM, Kusters JG. Effect of frequent consumption of a Lactobacillus casei-containing milk drink in Helicobacter pylori-colonized subjects. Aliment Pharmacol Ther. 2003;17:429–35.
6. Coconnier MH, Lievin V, Hemery E, Servin AL. Antagonistic activity against Helicobacter infection in vitro and in vivo by the human Lactobacillus acidophilus strain LB. Appl Environ Microbiol. 1998;64:4573–80.
7. Lorca GL,Wadstrom T, Valdez GF, Ljungh A. Lactobacillus acidophilus autolysins inhibit Helicobacter pylori in vitro. Curr Microbiol. 2001;42:39–44.
8. Nam H, Ha M, Bae O, Lee Y. Effect of Weissella confusa strain PL9001 on the adherence and growth of Helicobacter pylori. Appl Environ Microbiol. 2002;68:4642–5.
9. Aiba Y, Suzuki N, Kabir AM, Takagi A, Koga Y. Lactic acid-mediated suppression of Helicobacter pylori by the oral administration of Lactobacillus salivarius as a probiotic in a gnotobiotic murine model. Am J Gastroenterol. 1998;93:2097–101.
10. Kim TS, Hur JW, Yu MA, Cheigh CI, Kim KN, Hwang JK, Pyun YR. Antagonism of Helicobacter pylori by bacteriocins of lactic acid bacteria. J Food Prot. 2003;66:3–12.
11. Pinchuk IV, Bressollier P, Verneuil B, Fenet B, Sorokulova IB, Megraud F, Urdaci MC. In vitro anti-Helicobacter pylori activity of the probiotic strain Bacillus subtilis 3 is due to secretion of antibiotics. Antimicrob Agents Chemother. 2001;45:3156–61.
12. Mukai T, Asasaka T, Sato E, Mori K, Matsumoto M, Ohori H.Inhibition of binding of Helicobacter pylori to the glycolipid receptors by probiotic Lactobacillus reuteri. FEMS Immunol Med Microbiol. 2002;32:105–10.
13. Sgouras D, Maragkoudakis P, Petraki K, Martinez-Gonzalez B, Eriotou E, Michopoulos S, Kalantzopoulos G, Tsakalidou E, Mentis A. In vitro and in vivo inhibition of Helicobacter pylori by Lactobacillus casei strain Shirota. Appl Environ Microbiol. 2004;70: 518–26.
14. Midolo PD, Lambert JR, Hull R, Luo F, Grayson ML. In vitro inhibition of Helicobacter pylori NCTC 11637 by organic acids and lactic acid bacteria. J Appl Bacteriol. 1995;79:475–9.
15. Mack DR, Ahrne S, Hyde L, Wei S, Hollingsworth MA. Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut. 2003;52:827–33.
16. Arakawa T,Watanabe T, Kobayashi K. Regulation of acid secretion and peptic ulcer formation by inflammatory cytokines. In: Ernst PB, Michetti P, Smith PD, editors. The immunology of H. pylori: From pathogenesis to prevention. Philadelphia: Lippincott-Raven Publishers; 1997. p. 183–99.
17. Noach LA, Bosma NB, Jansen J. Mucosal tumor necrosis factor alpha, interleukin-1 beta, and interleukin-8 production in patients with Helicobacter pylori infection. Scand J Gastroenterol. 1994;29: 425–9.
18. Harris PR, Smith PD. The role of the mononuclear phagocyte in H. pylori-associated infection. In: Ernst PB, Michetti P, Smith PD, editors. The immunology of H. pylori: From pathogenesis to prevention. Philadelphia: Lippincott-Raven Publishers; 1997. p. 127–37.
19. Vitini E, Alvarez S, Medina M, Medici M, de Budeguer MV, Perdigon G. Gut mucosal immunostimulation by lactic acid bacteria. Biocell. 2000;24:223–32.
20. Drahoslava Lesbros-Pantoflickova,3* Ire`ne Corthe´sy-Theulaz,4 and Andre´ L. Blum5 Helicobacter pylori and Probiotics1,2. J. Nutr. 137: 812S–818S, 2007.
1. Jack RW, Tagg JR, Ray B. Bacteriocins of gram-positive bacteria. Microbiol Rev. 1995;59:171–200.
2. Klaenhammer TR. Genetics of bacteriocins produced by lactic acid bacteria. FEMS Microbiol Rev. 1993;12:39–85.
3. Michetti P, Dorta G, Wiesel PH, Brassart D, Verdu E, Herranz M, FelleyC, Porta N, Rouvet M, et al. Effect of whey-based culture supernatant of Lactobacillus acidophilus (johnsonii) La1 on Helicobacter pylori infection in humans. Digestion. 1999;60:203–9
4. Bernet-Camard MF, Lievin V, Brassart D, Neeser JR, Servin AL, Hudault S. The human Lactobacillus acidophilus strain LA1 secretes a nonbacteriocin antibacterial substance(s) active in vitro and in vivo. Appl Environ Microbiol. 1997;63:2747–53.
5. Cats A, Kuipers EJ, Bosschaert MA, Pot RG, Vandenbroucke-GraulsCM, Kusters JG. Effect of frequent consumption of a Lactobacillus casei-containing milk drink in Helicobacter pylori-colonized subjects. Aliment Pharmacol Ther. 2003;17:429–35.
6. Coconnier MH, Lievin V, Hemery E, Servin AL. Antagonistic activity against Helicobacter infection in vitro and in vivo by the human Lactobacillus acidophilus strain LB. Appl Environ Microbiol. 1998;64:4573–80.
7. Lorca GL,Wadstrom T, Valdez GF, Ljungh A. Lactobacillus acidophilus autolysins inhibit Helicobacter pylori in vitro. Curr Microbiol. 2001;42:39–44.
8. Nam H, Ha M, Bae O, Lee Y. Effect of Weissella confusa strain PL9001 on the adherence and growth of Helicobacter pylori. Appl Environ Microbiol. 2002;68:4642–5.
9. Aiba Y, Suzuki N, Kabir AM, Takagi A, Koga Y. Lactic acid-mediated suppression of Helicobacter pylori by the oral administration of Lactobacillus salivarius as a probiotic in a gnotobiotic murine model. Am J Gastroenterol. 1998;93:2097–101.
10. Kim TS, Hur JW, Yu MA, Cheigh CI, Kim KN, Hwang JK, Pyun YR. Antagonism of Helicobacter pylori by bacteriocins of lactic acid bacteria. J Food Prot. 2003;66:3–12.
11. Pinchuk IV, Bressollier P, Verneuil B, Fenet B, Sorokulova IB, Megraud F, Urdaci MC. In vitro anti-Helicobacter pylori activity of the probiotic strain Bacillus subtilis 3 is due to secretion of antibiotics. Antimicrob Agents Chemother. 2001;45:3156–61.
12. Mukai T, Asasaka T, Sato E, Mori K, Matsumoto M, Ohori H.Inhibition of binding of Helicobacter pylori to the glycolipid receptors by probiotic Lactobacillus reuteri. FEMS Immunol Med Microbiol. 2002;32:105–10.
13. Sgouras D, Maragkoudakis P, Petraki K, Martinez-Gonzalez B, Eriotou E, Michopoulos S, Kalantzopoulos G, Tsakalidou E, Mentis A. In vitro and in vivo inhibition of Helicobacter pylori by Lactobacillus casei strain Shirota. Appl Environ Microbiol. 2004;70: 518–26.
14. Midolo PD, Lambert JR, Hull R, Luo F, Grayson ML. In vitro inhibition of Helicobacter pylori NCTC 11637 by organic acids and lactic acid bacteria. J Appl Bacteriol. 1995;79:475–9.
15. Mack DR, Ahrne S, Hyde L, Wei S, Hollingsworth MA. Extracellular MUC3 mucin secretion follows adherence of Lactobacillus strains to intestinal epithelial cells in vitro. Gut. 2003;52:827–33.
16. Arakawa T,Watanabe T, Kobayashi K. Regulation of acid secretion and peptic ulcer formation by inflammatory cytokines. In: Ernst PB, Michetti P, Smith PD, editors. The immunology of H. pylori: From pathogenesis to prevention. Philadelphia: Lippincott-Raven Publishers; 1997. p. 183–99.
17. Noach LA, Bosma NB, Jansen J. Mucosal tumor necrosis factor alpha, interleukin-1 beta, and interleukin-8 production in patients with Helicobacter pylori infection. Scand J Gastroenterol. 1994;29: 425–9.
18. Harris PR, Smith PD. The role of the mononuclear phagocyte in H. pylori-associated infection. In: Ernst PB, Michetti P, Smith PD, editors. The immunology of H. pylori: From pathogenesis to prevention. Philadelphia: Lippincott-Raven Publishers; 1997. p. 127–37.
19. Vitini E, Alvarez S, Medina M, Medici M, de Budeguer MV, Perdigon G. Gut mucosal immunostimulation by lactic acid bacteria. Biocell. 2000;24:223–32.
20. Drahoslava Lesbros-Pantoflickova,3* Ire`ne Corthe´sy-Theulaz,4 and Andre´ L. Blum5 Helicobacter pylori and Probiotics1,2. J. Nutr. 137: 812S–818S, 2007.
Нийтлэлийн нээгдсэн тоо: 1920




