Изменения характера бактериальных инфекций, в последние годы, ставит перед клиницистами множество проблем, связанных с отсутствием методических подходов к микробиологической диагностик при микробных микстах и анаэробных неспорообразующих бактерий, влияющих на течение и исход септического шока (СШ) у детей раннего возраста. В группе микробиологически верифицированных инфекций самая высокая летальность выявлена от инфекций обусловленных грам-отрицательнымии [Гр( -)] бактериями. При этом микробиологическое подтверждение возможно лишь в половине случаев инфекций [5], а установление спектра возбудителей и выявление их резистентности удлинено по времени
Концептуальное определение сепсиса в настоящее время рассматривается [9,10] с позиций синдрома системногоnвоспалительного ответа (SIRS), согласно которой развитию СШ способствует гипервоспалительная реакция иммуной системы. Эндотоксинемия и Гр (-) бактериемия усиливают эффекты экзотоксинов [4], Эндотоксин связывается при посредстве липосахарида -связывающего протеина с СД-14- рецепторами макрофагов и полиморфядреных гранулоцитов, являясь триггером ответной реакции хозяина на
нагрузку эндотоксином [6], Этому предшествует генерализация инфекции приводящая к повреждающему воздействию микробных токсинов на кпетки [2], нарушению перфузии тканей, органной, а затем и полиорганной недостаточности.
Повышенная частота сепсиса и СШ, высокая летальность привели к разработке новых методов терапии направленных против различных элементов [7]
гипервоспалительногокаскада
Цель исследования; Изучение бактериального спектра и иммунологических сдвигов при СШ у детей раннего возраста и коррегирующего влияния плазмофереза и иммуномод^лина.
Материалы и методы: У 258 детей раннего (1-12 месяцев) возраста с генерализованным септическим состоянием, помимо рутинных методов исследований, было с1зучена бактериологическая картина крови, зева, мочи, кала. Уровень эндотоксикоза определялся по данным среднемолекулярных пептидов (СМП) [3], перекисного окисления липи)\ов (ПОЛ) [1], мочевины. Иммунологические исследования включали изучение клеточного (СДЗ, СД4, СД8, СД22) и гуморального (IgA, IgM, IgG) иммунитета [8].По выра)кенности клинических признаков СШ больные были разделены на 3 группы. Первую группу составили дети (96) с 1
степенью шока, вторую -(83) с П ст. , третью -(79) с Ш ст. Контрольную группу представили 23 относительно здоровых ребенка.Процедура лечебного плазмофереза (ЛП), проводимая на фоне общепринятых мероприятий, заключалась в последовательной эксфузии из подключной вены до 10% крови в пластиковый контейнер «Гемакон-50/30», центрифугировании контейнера на ресррс;кераторной центрифуге УЛП-3 в течении 15 мин. со скоростью 2000 об/мин., ресуспирирование глобулярного объема компонента крови и реинфузия эритроцитарной массы разведенным физиологическим раствором в соотношении 2: 1. Возмещение плазмы осущсствлялось переливанием СЗП и альбумина.
Статистическая обработка полученных результатов было осушествлена на IBM no программе «Statgrap». Результаты и обсуждеиие Клиническое бактериологическое обследование выявило чрезвычайно широкий спектр -19 видов инфицирующих микроорганизмов (табл.1), которые были высеяны из крови у 225 детей, что составило 87,20%. от всех исследуемых. 111 (49,3%) поло)кительных находок составила грамотрицательная флора, среди которой ведущее место занимали сракультативные анэробные палочки семейства Enterobacteriaceae: Enterobacter -19 (17,11%), Klebsiela pneumonia -22 (19,8%), E.Coli ~ 27 (24,34%), Citrobacter- 11 (9,9%), Proteus -14 (12,6%), Ps.Vulgaris-6 (5,4%). B 18 (8,2%) случаев из крови была высеяна аэробная палочка из семейства Pseudomonaceae -P.aerugenosa. В единых случайх
возбудителем сепсиса являлись грамотрицательные бактерии с не устоновленной семейственной принадле)кностью: сапрофит кишечника- А. Faecflis а также анаэробные бактерии семейства Bacteriodaceae.
Грампложительная спора составила 68 (30,22%) случаев всех положительных находок; при этом в 52% случаев это кокки из семейства Micrococuaceae. Характерно, что среди возбудителей сепсиса из рода Staphilococus превалировали его непатогенные штаммы: St. Epidermitidis (21%), и St. Saprofiticus (18%).
Достаточно высокий удельный вес среди установленых нами инфицирующих агентов, относящихся к полжительной флоре, заняли факультативные анаэробные кокки семейства Streptococcaceae -33,3%, среди которых преобладал патогенный стрептокок Pynrlbl В -Str. Pneumoniae -19 (27,94%)
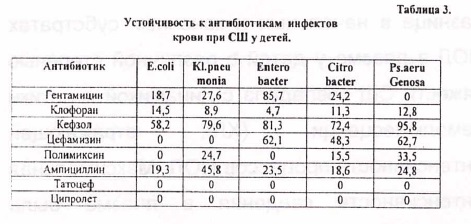
В 31 (3,77%) случайх была диагностирована генерализованная грибковая инфекция, ; вызванная дрожжеподобными одноклеточнГыми организмами Candida albicans, что свидетельствует о значительном увеличении грибковой инфекции в этиологической структуре сепсиса и сш у детей раннего возраста. У 34 (15,11%) детей диагностирована микст-инфекция (табл.2) характеризовавшаяся высевом из крови пациентов 2-3 микроорганизмов. Наиболее частым участником микробных ассоциаций были грибы рода Candida которые сочетались как с грамположительной, так и с грамотрицательной микрофлорой.
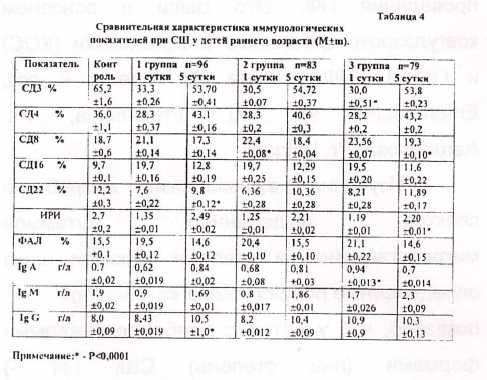
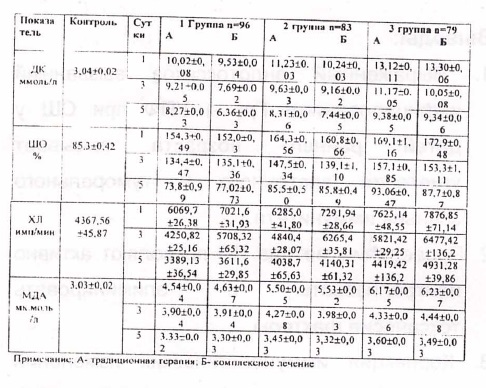
Только в 8,3% случаев при отрицательном результате бактериального посева инфицирующие микроорганизмы удалось идентфицировать из крови после проведения ПФ. 'Это были в основном коагулазоотрицательные стафилококки (КОС) и Гр( -) УПФ в виде St. Aureus, Е coli, Enterobacter sp., Kl. Pneumonia, Ps. Aerugenosa, Pr. Vulgaris. Изучение взаимосвязи микробного спектра выделенных штаммов микроорганизмов и степени тя)кести шока определенные по программе «Screening» показало, что у детей с наиболее тяжелыми формами (п-ш степень) СШ, Гр( -) микрофлора встречалась в 2,8 раза чаще, чем у детей с благоприятным течением (1 степень) шока. Преобладание указанной оппортунистической флоры, у детей с наиболее тяжелыми формами СШ, по всей видимости было связано с более глубокими иммунологическими нарушениями возникающими при септическом процессе вызванном Гр( -) микробами. Выявленная, исходная, иммуносупрессия клеточного звена иммунитета (табл.4) выразилась в сни)кение относительного и абсолютного количества Т-лимфоцитов (СДЗ) от 26 до 48%, Т-хелперов (СД4) от 12 до 41%, резком снижений показателей IgA. колличество В-лимфоцитов были повышены у большинства больных. Указанные нарушения иммунного статуса сопровождались снижением общего количества лимфоцитов и уровня IgG.. Определение исходного уровня показателей ПОЛ (табл.5) выявляет повышенное значение всех ее производных во всех исследуемых группах, но наиболее проявляемые у тяжелого контингента
больных. Проведенные исследования показали, что у детей с более тяжелыми формами СШ (2-3 группы), при поступлении, отмечаетсй более высокая интенсивность процессов ПОЛ. Уровень первичных продуктов ПОЛ -диеновых коньюгатов (ДК) в плазме был на 28,7% (р<0,02) больше, чем у детей 1 группы (табл, 5), Наиболее высокий уровень ДК в плазме отмечается у детей с неблагоприятным исходом заболевания (3 группа) который достигал 13,12:tO,11 мкмоль/л, т,е, в 1,5 раза выше чем в 1 группе и в 1,2 раза (р<0,001) выше чем во 2 группе. Существенная количественная разница в начальных и конечных субстратах ПОЛ в плазме у детей с различной степенью тяжести СШ совпадала с динамикой кинетики хемолюнесценци (ХЛ), отражающей интенсивность процессов ПОЛ. Максимальная интенсивность сведения в плазме была обнару)кена у больных с неблагоприятным исходом заболевания 7625,14:t 48,55 , что в 1,2 раза (р<0,001) выше, чем у детей 1 и 2 Pynrl, Болбе высокая интенсивность ХЛ отмечалась у детей 2 и 3 групп по сравнении с 1 группой, соответственно в 1,1 (р<0,00 1) и 1,2 (р«Э.ОО 1) раза,
Полученные результаты свидетельствуют о том, что интенсивность свободно радикального окисления липидов определяет тяжесть септического шока у детей. анаологичые данные, при определении уровня малонового алдегида (МДА) и перкисного гемолиза, были получены в исследованиях А.В, Петренко (1987), В.В. Эстрина (1996), 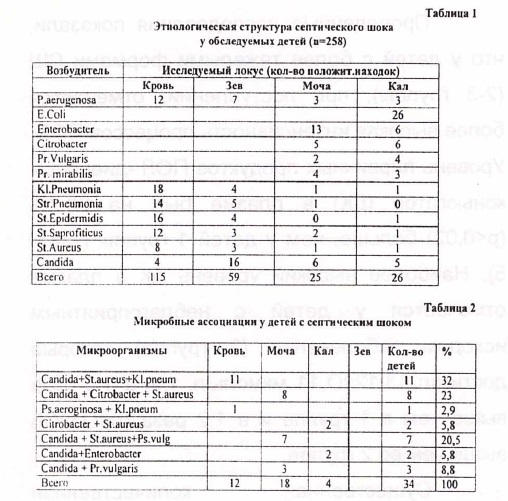
По всей видимости, в генезисе нарастающей интоксикации процессов ПОЛ, при тяжелых и особенно летальных формах СШ, играют роль все факторы усиления ПОЛ при экстремальных состояниях, которые были отмечены выше
Снижение интенсивности XJ1 в динамике происходило на 7-10 день и коррелировало с уменьшением в плазме уровня ДК. Искпючение составляли дети 2 группы, у которых достоверное сни)кение XJ1 с 8060:t320 no 5299:t214 происходило на 4-5 день 10-15 сутки интенсивность ХЛ снижалась в 1 группе по сравнении с фоном в 2,2 раза (р<0,00 1), У детей 2 и 3 групп в 2 раза (р<0,00 1). Однако из-за более высоких фоновын показателей ХЛ её уровень во 2 и 3 группах на 15 сутки был в 1,7 раза (р<0,00 1) болыие, чем у детей 1 группы.
 Проводимые традиционные
Проводимые традиционные
противошоковые мероприятия недостаточно полно регулировали процессы восстановления органных изменений, не в полной мере уменшели степень эндотоксикоза у наиболее тяжелого контингента больных. Неблагошприятние течение СШ. при таком сочетани инфекта, отражалось на общем состояний больных. В комплекс противошоковых меропритий всем больным была вклю^ино введение иммуномодулятора (иммуномодулин 1мг/кг) в течений 4-6 суток и процедура прерывистого ЛП больным 2 и 3 групп, на 2-3 сутки от момента развития шоковых проявлений. Отмечаемое улучшение состояния больных было связано, по всей видимости, не только с количественным снижением токсических агентов, но и также с плазмо-альбумино возмещением, Обращает на себя внимание тот факт, что не всегда клинической улучшение течения СШ и степень токсикоза коррелировали с данными лабораторных исследований после первого сеанса ЛП. На 2-3 сутки после ЛП у 8
больных 2 группы и у 12 больных 3 группы отмечалось нарастание СМП и МДА, что вызвало необходимость повторного сеанса
Только у 6 больных 3 группы возникла необходимость проведения третьего сеанса ЛГ1, в связи CO стойкой эндотоксемией, труднорегулируемой гемодинамикой,
развернутой картниной СШ, трудно паддающейся коррекции традиционными средствами, Каких либо серьезных осложнений при проведении ЛП на наблюдалось. Анализ полученных иммунограмм (табл,4), после проведенного комплексного лечения, выявляет однонаправленные изменения показателей во всех группах с восстановлением основного пулаТ- лимфоцитов, отчетливо отразившихся на субпопуляциях клеток хелперов и супрессоров, восстановлении оптимальных соотношений ме)кду субпопуляциями хелперы/индукторы и супрессоры киллеры. Выявленное повышение В-лимфоцитов сопровождалось нивелированием гуморального звена иммунитета экстраполирующееся на клиническом состоянии исследуемых. Повидимому, иммунокоррегирующее действие комплексной терапии оказываетполо)кительное влияние при дисрегуляции иммунитета, что согласуется с данными литратурных источников [2,3,6].
Проведение ПФ и введение иммуноглобулина повышает реакцию иммунитета, что наиболее отчетливо проявляется в поддержании соотношений между популяциями Т лимфоцитов и предотвращения угнетения их
функциональной активности.
Нужно полагать, что элиминация токсинов из крови и нейтрализация их в самом русле вызывает положительный пролиферативный ответ. Данное предположение подтверждается полученным сведением о снижении уровня интоксикации, устранении нарушений гомеостатических потенциалов к 5 суткам течения СШ.
Необходимо обратить внимание на то, что ряд исследований иммунных показателей, имея положительную динамику, все же не достигают контрольных значений к 5 суткам наблюдения. Данное обстоятельство указывает на целесообразность разработки более эсрсрективной терапевтической стратегии.
Выводы:
1. Выраженный эндотоксикоз вызванный инфицированием Гр( -) УПФ при СШ у детей раннего возраста вызывает угнетение клеточного и гуморального
звеньев иммунитета.
I
2. Проведейие метода ЛП позволяют активно нейтрализовать и элиминировать токсичесие факторы.
3. Коррекция иммунологических изменений введением иммуноглобулина, на фоне ЛП, позволяет повысить пролиферативный ответ иммунокомпетентных клеток.
Иммуно-бактериологические параллели при септическом шоке у детей раннего возраста
Бактериологическое исследование проведенное у детей раннего возраста, с генерализованным септическим состоянием в период септического шока (СШ) выявляет преобладание оппортунистической Гр( -) условно-патогенной флоры. Исходно определено повишение интенсивности перекисного окисления липидов (ПОЛ) с иммуносупрессий кпеточного и гуморального звеньев иммунитета. Включение в комплексную программу лечеНИЯ СШ метода лечебного плазмофереза (ЛП) и иммуномодулина оказывает стимулирующее воздействие на гомеостатические потенциалы. Нивелирующее влияние примсняемой методики положительно
влияет на дальнейшее течение заболевания, способствует просрилактике развивающихся осложнений.
2. Винницкий Л.И., Витвицкая И.М., Попов О.ю. Иммуная терапия сепсиса -миф или реальность / A necm. и реаним. 1997, N2 3 , с. 89-95.
3. Гаврилов В.Б., Машкорудная М.И., Спектрофотометрическое определение содержания гидроперекисей липидов в плазме крови. //Лаб. дело. 1984,3, с. 138-140.
4. Клиническая иммунология. Под ред. Е. У. Соколова. -М:- Медицина, 1998. -264 с.
5. Ковальчук Л.В., Чередеев А .Н. Иммунология. -М; Медицина, 1987,-414с.
6.Самсыгина Г.А., Корнюшин М.А., Чечкова О.Б. Эволюция возбудителей гнойно Воспалителвних заболеванийу новорожденных. //Педиатрия (Г.М. .Сперанского),1997,3N2,c.10-14.
7. Тимохов B.C., Яковлева И.И., Калашникова Е.А., Ипфпьева Е.И. Содержание в плазме цитокинов и их клиренсов при постоянной гемофильтрации у больных с
сепсисом и полиорганной недостаточностью. //Анест. и реаним. 1997, N2 3, с. 59-61.
8. Ярилин А.А. Основы иммунологии. -М: Медицина, 1999,607 c..
9. Alexander H.R., Doherty G.M., Fraker D.L. et a .// J. Surg/Res.- 1991,-Vol.50.-P.421 424.
10. Ваггега MJansen E.M., Demacker P .N. et a/// Lymphokine Cytokine Res.-1992. 11.-P.99-104.
11. Baue A.E. //Sepsis and Organ Failure. / Ed. A. GuHo.- Trieste, 1994,- P-9-39.
12.Bone R.C.// Shock, Sepsis and Organ Failure: Third Wigers Bernard Conference Cytokine Network / Eds G. Schlag et al.-Berlin, 1993,-P.293-306.




