Эрүүл мэндийн шинжлэх ухааны их сургууль
Gastric Cancer is second leading cause of the cancer related death in Mongolia (National Cancer Center, report-2006). Chronic infection with Helicobacter pylori affects approximately half the world and results in malignancy in a small subset of this population.1,2 There was suffi cient evidence that the Working Group of the International
Agency for Research on Cancer (IARC-1994) classifi ed it as a class I carcinogen, the only bacterial agent on this list. H. pylori infection is the primary cause for the
development of gastric cancer.3, 4, 5 But only a small percentage of infected patients develop malignancy, it is of major interest to identify bacterial and host genetic
markers associated with cancer development.6 The aim of the study is to detect and defi ne the role of H.pylori virulence factors and host IL-1 polymorphisms to prevent
from further gastric cancer. In the future, this combined bacterial/host genotyping may provide an important opportunity to identify patients who are at high risk for the development of gastric carcinoma long before malignancy occurs.7, 8, 9
Patients and biopsy specimens
Two biopsy specimens and 5ml of blood samples were collected from each of 59 patients who had abdominal complaint, after informed consent was obtained. All patients
lived in Ulaanbaatar, Mongolia, 100% were Mongolian nationality. Their mean age was 40.33 years (range, 15–75 years). The biopsy specimens were stored in liquid nitrogen and homogenized before DNA isolation. After tissue lysation with proteinase K, DNA isolation was performed with “Promege” tissue kit, according to the manufacturer’s instructions. Extraction of DNA from blood sample was used by also “Promega” blood kit. PCR for H. pylori genotyping. PCR amplifi cation of H.pylori gene loci was performed for the cagA gene and the vacAs mosaics vacAs1 and vacAs2. Two different primer sets were used to amplify the middle region and 3_ end of the cagA gene. Genotyping of IL-1 polymorphisms. IL-1B polymorphisms were distinguished by 2 methods, 5_ nuclease PCR assay and restriction fragment–length polymorphism analysis (RFLP).10, 11, 12
Result
Result of endoscopy shows 84.7% from all patients were diagnosed with gastritis (50/59). 2 patients diagnosed with gastric ulcer and 1 patient with duodenal ulcer. 6 patients
were none pathologic changes seen by endoscopy. Strain characteristics of H. pylori were investigated in all 59 patients and 40 patients from 59 were infected with H. pylori, as determined by UreC PCR. 29 patients (11 men and 18 women) from 38 were infected with H. pylori, as determined by urea test. The vacAs1 genotype was found in 52.5% (21/40) of all UreC+ patients, and cagA was found in 60% (24/40) of UreC+ patients. 16.9% of all patients were IL-RN*2 positive (10/59), IL-1B 31C/511T were positive in 20.3% of all patients (12/59).
Conclusion
H. pylori infection is the primary cause for the development of gastric cancer.13 Our current result shows that 66.7% of all chronic gastritis, and 65.6% of all antral gastritis are associated with H.pylori infection, respectively. The presence of the vacAs1 gene was associated with the cagA gene, because 80.9% of all vacAs1+ strains were simultaneously cagA+ (17/21). All vacAs2+ strains were simultaneously cagA- (3/3).
Pp.37-40, Tables 4, Pictures 7, References 13
Үндэслэл. Монгол оронд хавдрын шалтгаант нас баралтын 2-р байранд ходоодны хавдар ордог байна (ХСҮТ-мэдээлэл, 2005). Ходоодны хавдар нь тохиолдлоороо Ази тивд харьцангуй элбэг ба дэлхий нийтэд нийт хавдрын тохиолдлууд дунд 4-рт орж байна (World Cancer Report, IARC, 2006). Хеликобактер пилори (H.pylori) -ийн шалтгаант ходоодны эмгэгийн 20-30% орчим нь хавдарт шилждэг бөгөөд олон улсын хавдар судлалын нийгэмлэг (International Agency for Research on Cancer, 1994)-ийн тэмдэглэснээр I төрлийн канцероген бүлэгт хамаарах цорын ганц нян хэвээр байна. Хавдарт шилжих эрсдэл нь H.pylori халдвар тээгчийн удмын хүчин зүйл (IL-1B,IL-RN генийн зарим полиморфизм) болон бактерийн генотипээс (VacA, CagA ген) хамаарч харилцан адилгүй байдаг байна.1,2,3 IL-1B нь ходоодны эсийн үйл ажиллагаа болон үрэвслийн хариу урвалын зохицуулагад чухал нөлөөтэй цитокин юм. IL-1 цитокиний мэдээллийг 2- р хромосомын урт мөрөн дээр орших 3 ген (IL-1A, IL1-B, and IL-1RN) кодлох ба IL-1B, IL-RN генийн полиморфизм нь IL-1B цитокиний нийлэгжилтийг in vitro болон in vivo орчинд ихэсгэдэг байна (Зураг 1)
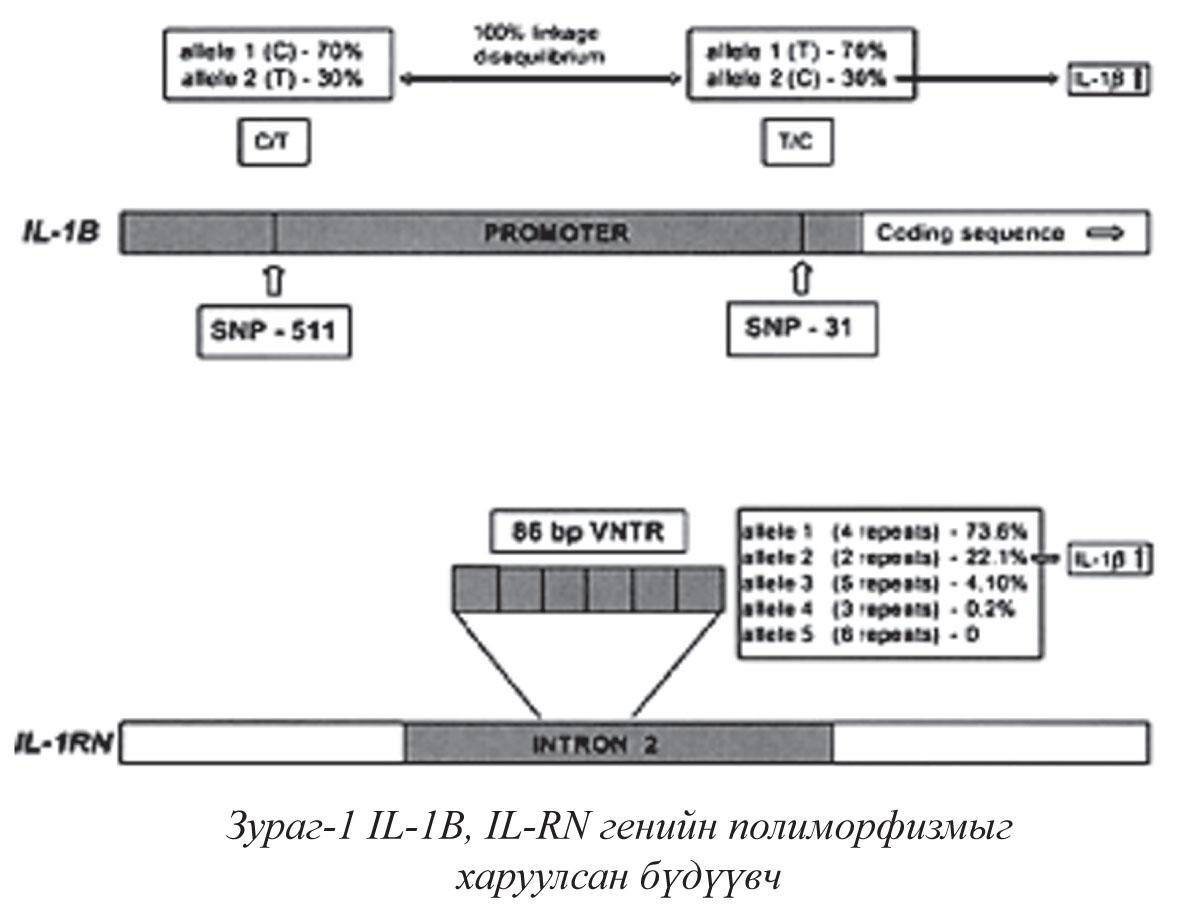
Vacuolating cytotoxin-А (VacA)-хоруу чанарийн ген бүхий хеликобактер нь эс хордуулах цитотоксинийг ялгаруулдаг бөгөөд уг цитотоксин нь Cytotoxin associated gene A (CagA) генийн экспрессийг ихэсгэн, дархлааг өдөөж үрэвслийн хариу урвалыг хүчтэй өрнүүлдэг4,5. Иймд:
- Халдварласан нян VacA, CagA хоруу чанарын гентэй байх
- Өвчтөний удмын хүчин зүйл болох IL-1B генийн 31C/511T, IL-RN генийн IL-1RN*2 полиморфизмтой байх нь өвчний явц даамжрахад хам нөлөө үзүүлж, хавдарт шилжих эрсдлийг ихэсгэдэг байна. 6,7
Зорилго. Эмнэлзүйдээ ходоод болон хоол боловсруулах замын эмгэгтэй өвчтөнд IL-1B, ILRN генийн полиморфизм болон H.pylori-ийн өндөр эрсдэлт хэв шинжийг илрүүлж хавдарт шилжих эрсдлээс урьдчилан сэргийлэхэд манай судалгааны ажлын зорилго оршино.
Зорилт:
- Судалгаанд хамрагдагсадаас зөвшөөрөл авч гарын үсгээр баталгаажуулан асуумж авах.
- Судалгаанд хамрагдагсадаас ходоодны эдийн сорьц болон захын цуснаас шинжилгээний дээж цуглуулах.
- Эдээс болон цуснаас ДНХ ялгах.
- ПГУ (полимеразын гинжин урвал) болон зүсэгч ферментийн арга (Restriction fragment length polymorphism)-аар IL-1B, IL-RN генийн полиморфизм болон H.pylori-ийн генотипийг тодорхойлох.
- Эмнэлзүй, дурангийн оноштой харьцуулан дүгнэлт гаргах.
Материал, арга зүй. Манай судалгаанд Шастины Нэрэмжит Клиникийн Төв Эмнэлэг (ШНКТЭ)-ийн онош зүйн тасаг, Улсын Клиникийн Төв Эмнэлэг (УКТЭ)- ийн Хоол боловсруулах эрхтэн (ХБЭ) судлалын тасаг, Намун хувийн эмнэлгийн ходоодны дурангийн тасагт ходоод болон хоол боловсруулах зам (ХБЗ)- ын зовиурын улмаас дурангийн шинжилгээ хийлгэж байгаа 15–75 насы (эрэгтэй 28, эмэгтэй 31) нийт 59 өвчтөнөөс судалгааны карт бөглүүлж уреазын сорил болон H.pylori-ийн генотипыг нь тодорхойлохын тулд тус бүр 2 эдийн сорьцыг фосфатын давсны буфер (phosphate buffer saline-PBS) уусмалд авав. Мөн өвчтөн тус бүрээс EDTA бүхий вакутейнерийн системээр тус бүр 3мл цусыг, хоосон вакутейнерын системээр 3мл цусыг тус тус авсан.
Арга зүй. ДНХ ялгах: Судалгаанд хамрагдсан өвчтөний эдийг шингэн азотоор хөлдөөж нунтаглан Promega багцыг ашиглан эдээс ДНХ ялгах протоколын дагуу ДНХ-г ялгасан. Цус бүлэгнэлтийн эсрэг EDTAтай авсан цуснаас мөн Promega багцыг ашиглан цуснаас ДНХ ялгах протоколын дагуу ДНХ-г ялгасан. Ялгасан ДНХ 0.5% агарозийн гель электрофорезоор батлаж хяналт тавьсан.
Цуснаас ДНХ ялгах:
- Ариутгасан 1.5 мкл микроцентрефугийн тубе
- 370С усан ванн
- Изопропанол, тасалгааны темпратур
- 70% этанол
- 650 усан ванн
- 1.5мл ариутгасан микроцетрфугны тубенд 300мкл цусан дээр 900мкл эс задлах уусмал (cell Lysis solution)хийнэ.
- 5-6 удаа зөөлөн холино.
- Тасалгааны темпратурт 10 минут инкубацлана (инкубацлах явцдаа 2-3 удаа холино ). Улаан эсийг задлана. 13 000-16 000*g 20 секунд центрифугдэнэ.
- Дээдэх шингэнийг асгана. Үлдсэн тундас нь 10-20 мкл орчим үлдэнэ.
- Хананаас цагаан эсийг vortex-дож салгана (10- 15с).
- 300 мкл Nuclei Lysis solution нэмнэ. 370C-д нэг цаг инкубацлана.
- 1.5 мкл RNA-asa Solution нэмнэ. 2-5 удаа холино. 370-д 15’-т инкубацлана.
- 100мкл Protein Preciptation Solution хийж 10-20 секунд vortex-доно. Үүний дараагаар уургийн жижиг хэсэг харагдана.
- 13 000-16 000*g 3 минутын турш хурилдуурдана. Бараан тундас харагдана.
- Цэвэр 1.5 мкл микроценрифугэнд шингэнийг хийж 300 мкл изопропанол нэмнэ.
- Зөөлөн холино. Энэ үед цагаан ДНХ утаслаг харагдана.
- 13 000-16 000*g 1 минут центрифугдэнэ. ДНХ тубены ёроолд тунана.
- Дээд шингэнийг нь асгаж, 70% этанолоор ДНХ-г угаана. 13 000-16 000*g 1’ центрифугдэнэ. ДНХ тубеныёроолд тунана
- Этанолыг болгоомжтой соруулж аван үлдэгдэл спиртийг 10-15 минут агаарт ууршуулна.
- 100 мкл DNA Rehydration Solution нэмээд 650-д нэг цаг инкубац хийнэ.
- 40-д хадгална.
Эдээс ДНХ ялгах
- 1.5 мкл микроцентрефугийн тубе
- 0.5М EDTA (pH8.0)
- Proteinase K
- 370С усан ванн
- Изопропанол, тасалгааны темпратур
- 70% этанол
- 650С усан ванн
- Шингэн азот
- Эдийг шингэн азотоор хөлдөөж, нухна
- Сорьц бүрд 120 мкл 0.5М EDTA (pH8.0), 500мкл Nuclei Lysis Solution бодож -200С-д хэсэг хугацаанд байлгана.
- Хэсэг хугацааны дараа 600 мкл 0.5М EDTA (pH8.0)/Nuclei Lysis Solution эд дээрээ нэмж хийнэ.
- 17.5мкл Proteinase K(20мг/мл) хийнэ
- 550-д шөнийн турш инкубацлана
- 3 мкл RNAase Solution хийж 2-5 удаа холино. 370- д 30 минут инкубацлана. Энэ шатыг хийхээс 5 минуты өмнө тасалгааны температурт хүргэнэ
- Тасалгааны температурт 200мкл Protein Precipitation Solution хийгээд 20 секунд vortex-дэнэ. Сорьцыг 5 минут хөргөнө.
- ДНХ агуулсан шингэнийг нь 600мкл изопропанолтой цэвэр 1.5мл ценрифугны тубенд шилжүүлнэ.
- Зөөлөн холино. Энэ үед цагаан ДНХ утаслаг харагдана.
- 13 000-16 000*g 1’ центрифугдэнэ. ДНХ тубены ёроолд тунана.
- Дээд шингэнийг нь асгаж, 70% этанолоор ДНХ-г угаана. 13 000-16 000*g 1’ центрифугдэнэ. ДНХ тубены ёроолд тунана
- Этанолыг болгоомжтой соруулж аван үлдэгдэл спиртийг 10-15 минут агаарт ууршуулна.
- 100 мкл DNA Rehydration Solution нэмээд 650-д 1 цаг инкубац хийнэ.
- 40С-д хадгална.
Полимеразын гинжин урвал
Бие махбодын удмын эрсдэлт хэв шинжийг тогтоохын тулд цуснаас ялгасан ДНХ-д IL-1В полиморфизмийг IL-1B, IL-RN primer агиглан тодорхойлсон. H.pylori-ийн сорьцонд илрүүлэн, эерэг гарсан сорьцондоо удмын хэв шинжийг тогтоохын тулд CagA, VacA генд өвөрмөц праймер (primer) ашиглав. 1-р хүснэгтэд үзүүлэв.

Уреазын сорил
Дурангийн явцад авсан эдийн сорьцонд Мон-НР уреаза тестийг ашиглан уреазын сорил тавьсан. 8,9,10
Үр дүн:
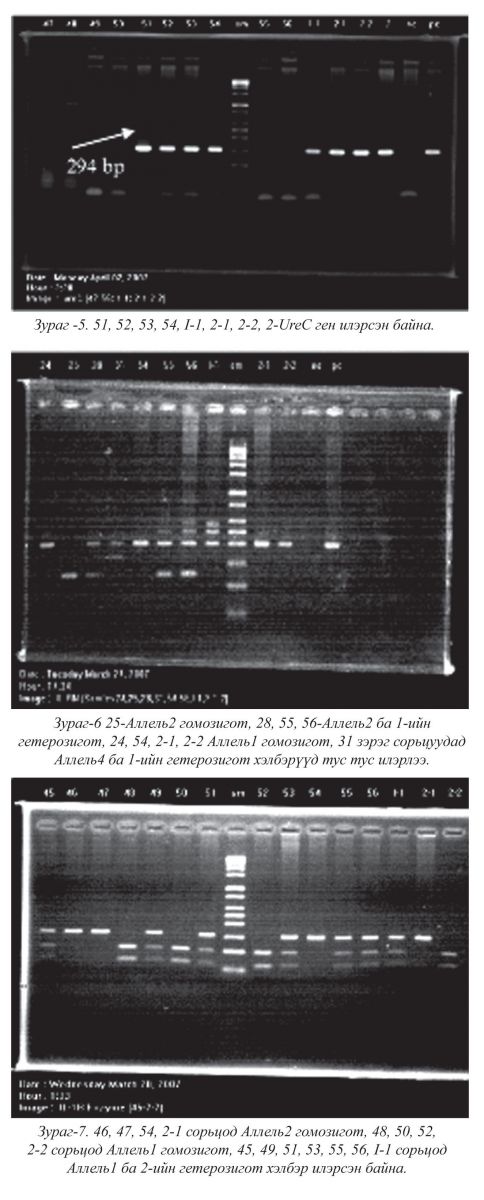
Дурангийн шинжилгээгээр нийт өвчтөний 84.7% (59/50) нь Гастрит, үүнээс 64% (50/32) нь ходоодны гарах хэсгийг хамарсан архаг үрэвсэлтэй байлаа. Нийт шинжлүүлэгчдийн 3.4% (59/2) нь ходоодны нугалуур хэсгийн шархтай байлаа. Уреазын сорил хийлгэсэн нийт сорьцын 76.3% нь эерэг (38/29). H.pylori UreC ген бүх сорьцын 67.8%-д (59/40) илэрлээ. (294 bp урттай) Нийт өвчтөний 16.9% (59/10)-д IL-1RN*2 полиморфизм илэрсэн ба 10% (10/1) нь гомозигот, үлдсэн нь гетерозигот байлаа. Харин IL-1B-ийн Аллель2 (31C/511T) полиморфизм 20.3%(59/12) илэрлээ.
Дүгнэлт:
- Ходоодны архаг үрэвсэл (ХАҮ)- тэй нийт өвчтөний 68% (34/50) нь h.pylori илрүүлэх полимеразын гинжин урвал (ПГУ) буюу UreC эерэг байгаа нь ХАҮ-тэй өвчтөнд H.pylori-ийн тархалт өндөр байгааг харуулж байна. (82,6%-Оюунцэцэг Х. 2003, 72-90% -Сарантуяа.Ц 2005, 70%-Ghose C, Perez-Perez GI, 2002, USA)
- H.Pylori илрүүлэх МОН- HP уреаза сорилын мэдрэг чанар (96%), өвөрмөц чанар (72%) байсан нь бусад судлаачдынхтай ойролцоо үр дүн байлаа. 11
- ХАҮ болон ходоод дээд гэдэсний шархтай нийт өвчтөний 65.3%-д IL-1B-ийн эрсдэлтэй полиморфизм илэрсэн нь өвчний явцад хамааралтайг баталж байна.
- IL-RN генийн эрсдэлтэй полиморфизм 16.9%-д илэрсэн нь бусад орны судлаачдын үр дүнтэй ойролцоо айгаа нь харагдлаа. 12
- H.pylori VacA + нийт тохиолдлын 70.8% (17/24)-д CagA+ байгаа нь генүүдийн хооронд хамааралтай байгаа нь харагдаж байна.13
- Оношлогоонд IL-1B-ийн эрсдэлтэй полиморфизм болон H.pylori-ийн хоруу чанарын хэв шинжийг эрт илрүүлэх нь ач холбогдолтойг бидний судалгааны үр дүн харуулж байна. Иймд бид цаашид судалгааны цар хүрээг өргөжүүлэн судалгаагаа үргэлжлүүлэн хийх болно.
2. Ghose C Dominguez-Bello MG, et al “East Asian genotypes of Helicobacter Pylori strains”, Nat Rev Cancer 2002, 2:28-37
3. Figueiredo C, Machado JC, Pharoah P, Seruca R, “Helicobacter pylori and interleukin 1 genotyping: an opportunity to identify high-risk individuals for gastric carcinoma.J Natl Cancer Inst. 2002 Nov 20;94(22):1680-7.
4. F, Basso G, Rugge M, Plebani et al, M.Helicobacter pylori virulence genes and host IL-1RN and IL-1beta genes interplay in favouring the development of peptic ulcer and intestinal metaplasia. Cytokine. 2002 Jun 7;18(5):242-51.
5. Chen A, Li CN, Hsu PI, Lai KH, Tseng HH, Hsu PN, Lo GH, Lo CC, Lin CK, Hwang IR, Yamaoka Y, Chen HC.Risks of interleukin-1 genetic polymorphisms and Helicobacter pylori infection in the development of gastric cancer. Aliment Pharmacol Ther. 2004 Jul 15;20(2):203-11.
6. Machado JC, Pharoah P, Sousa S, Carvalho R, Oliveira C, Figueiredo C, Amorim A, Seruca R, Caldas C, Carneiro F, Sobrinho-Simoes M.Interleukin 1B and interleukin 1RN polymorphisms are associated with increased risk of gastric carcinoma. Gastroenterology. 2001 Oct;121(4):823-9.
7. He X, Jiang L, Fu B, Zhang X. “Relationship between interleukin- 1B and interleukin-1 receptor antagonist gene polymorphisms and susceptibility to gastric cancer” 2002 May 25;82(10):685-8.
8. Harris, P. R., H.L. Mobley, G.I. Perez-Perez, M.J. Blaser and P.D. Smith. 1996. Helicobacter pylori urease is a potent stimulus of mononuclear phagocyte activation and infl ammatory cytokine production. Gastroenterology 2003 Oct;121(3):413-9.
9. Smoot, D.T., H.L. Mobley, G.R. Chippendale, J.F. Lewison, and J.H. Resau. 1990. Helicobacter pylori urease activity is toxic to human gastric epithelial cells. Infect. Immun. 2002 Sep;121(4):823-9.
10. Eaton, K. A. and S. Krakowa. 1994. Effect of gastric pH on urease dependent colonization of gnotobiotic piglets by Helicobacter
pylori. Infect. Immun. 2004 Oct;211(2):827-9.
11. Katoh, M., D.Saito, T. Nado, S. Yashido, Y. Oguro, Y. Yazaki, T. Sugimura and M. Teruda. 1993. Helicobacter pylori may be transmitted through gastrofi berscope even after manual hyamine washing. Japen. J. Cancer Res. 2001 Nov;211(2):827-9.
12. Mitchell, H.M., A. Lee, and J. Carrick. 1989. Increased incidence of Campylobacter pylori infection in gastroenterologists:
further evidence to support person-to-person transmission. Scand. J. Gastroenterol 2004 Oct;211(2):993-9.
13. RolandRad, Christian Prinz, Bruno Neu, Mathlide Neuhofor, Marco Zeitner, Petra Voland, Ingrid Becker, Wolfgang Schepp and Markus Gerhard. 2003. Synergistic Effect of Helicobacter pylori Virulence Factors and Interleukin-1 Polymorphisms for the Development of Severe Histological Changes in the Gastric Mucosa Gastroenterol 2005 Nov;211(4):673-9.




