ЭМШУИС, Эрүүл ба Эмгэг Физиологийн тэнхим
Эмч хүн өвчнийг эмчлэхийн тулд түүний эмгэг жамыг нэн сайн ойлгосон байх нь чухал төдийгүй үргэлж сэтгэгч, судлаач байх ёстой билээ. Иймээс ч та бүхэнд судас хатуурлын эмгэг жамын сүүлийн үеийн ойлголтуудаас хураангуйлан хүргэхийг зорилоо. Шинэ мянганы эхлэл дээр бид атеросклерозын талаар их зүйлийг мэдэж авсан боловч атеросклерозын эмгэг жамд судлагдаагүй зүйлс олон байна. Жишээлбэл, бид яагаад артерийн модны тодорхой хэсгүүд дээр атеросклероз болдгийг, яагаад нэгэн ижил цаг хугацаанд клиник илрэл нь илэрдгийг дөнгөж судалж эхэлж байна. Судас хатуурлын улмаас цус хомсодсон эрхтэнд шинээр судас ургуулан цус хүргэх арга замыг хайн, зарим нь өөрсдийн үр дүнгээ нийтэд зарлаж байна.1-3 Тиймээс монгол эмч, судлаач та бүхэн миний бичсэнийг зөвхөн уншаад орхих биш, өөрийн санаагаа илгээж, ухаан бодлоо уралдуулна гэдэгт итгэж байна.
Эндотелийн үйл ажиллагааны алдагдал болон гэмтэл: Одоо үед липидийн агууламж ихтэй хоол хүнс нь судасны дотор хананы зузаарал, атерома үүсгэдэг нь бүрэн батлагдсан.4-6 Гэхдээ л эхэн үеийн судас хатуурлын шарх (lesion) нь морфологийн хувьд эрүүл эндотелийн эсээс үүсдэг нь бидэнд тодорхой билээ. Иймээс хүнд тохиолдох хэлбэрийн хувьд эмгэг үүсэх нь магадгүй ямар нэг бүтцийн өөрчлөлтөнд өртөгдөөгүй эндотелийн эсийн үйл ажиллагааны өөрчлөлт нь эндотелийн нэвчимтгий чанар ихэсгэх, лейкоцитийн адгезийг нэмэгдүүлэх мөн эндотелийн эсийн генийн бүтээгдэхүүний ялгаралтанд эмзэгшил үүсгэх байдлаар судас хатуурлыг эхлүүлж байж магадгүй гэж ихэнх судлаачид үзэж байгаа юм.4,7,8 Өөрөөр хэлбэл, архаг явцтай болон дахин дахин өдөөгдөх эндотелийн гэмтэл нь судас хатуурал үүсэх онолын гол суурь нь юм.
Туршилтын амьтдад механик үйлчлэл, гемодинамикийн хүчдэл, дархлалын иммунокомплексын хуримтлал, цацраг идэвхт туяа болон химийн шалтгаануудаар судасны дотор хананд гэмтэл үүсэж, дасан зохицлын зузаарал үүсгэж байсан.4 Гэмтээгч олон хүчин зүйлүүдээс тамхины цусанд эргэлдэгч бүтээгдэхүүнүүд, хомоцистейн болон зарим вирус, халдвар үүсгэгчдийг эмгэг жамын эхэн үед өндөр үүрэгтэйгээр оролцох магадлал их хэмээн үзэж байгаа юм.9,10 Үрэвслийн цитокинүүд ялангуяа хавдар үхжүүлэгч хүчин зүйл(TNF), интерлейкин 1 (IL-1) нь судас хатуурлыг идэвхжүүлж, дэмжих шинж чанар бүхий генүүдийн экспрессийг эрчимжүүлж өгдөг байж магадгүй (Зураг 1).
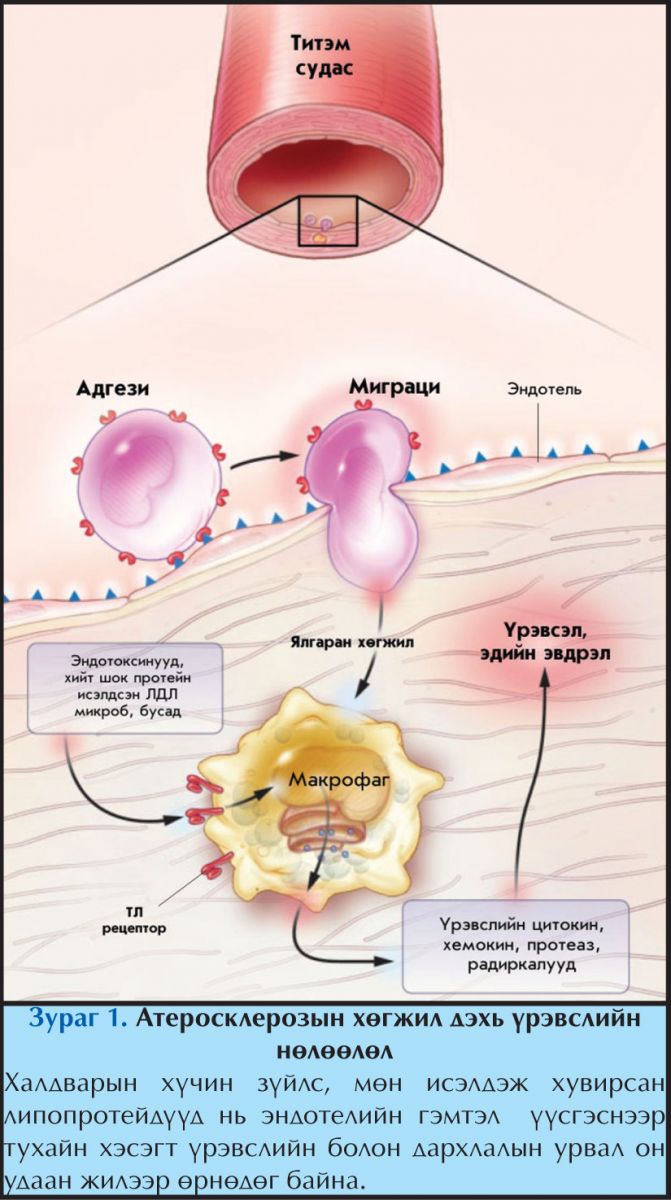
Гэхдээ, эндотелийн гэмтлийг үүсгэгч хоёр хүчтэй төлөөлөгч бол цусны эргэлтийн гемодинамикийн алдагдал болон гиперхолестеролеми юм. Аортоос салбарлан гарсан судаснуудын салаалсан хүзүү хэсгүүд, аортын арын хана зэрэг хэсгүүдэд цусны урсгалын хүчдэл болон чиглэлийн өөрчлөлт ихээр илэрдэг.11 Цусны турбулянт урсгал ихтэй болон shear стресс багатай хэсгүүд нь судас хатууралд өртөмтгий, харин зөөлөн, ламинар урсгалтай хэсгүүд нь судас хатуурлаас хамгаалагдсан байдаг байна. Хэвийн ламинар урсгал нь эндотелийн үйл ажиллагаа алдагдах, судас хатууурлын товруу үүсэхэд гол материаллаг суурь болдог эндотел эсийн апоптоз үүсэхэд хүргэдэг үрэвслийн явц үүсэхээс хамгаалж, хориг үүсгэдэг. Мөн түүнчлэн хатуурлын эрт үеийн шарх үүсэхээс хамгаалах үйлдэл бүхий супероксид дисмутаза (SOD), глютатион пероксидаза (GPx) зэрэг антиоксидантуудын нийлэгжүүлдэг эндотел эсийн генүүдийн нийлэгжлийг ихэсгэн идэвхжүүлэх нөлөөг үзүүлдэг.11,12
Эсийн гаднах липидийн хуримтлал: Судас хатуурал хэрхэн эхэлдэг талаар бүрэн батлагдсан механизм байхгүй бөгөөд ихэнх онол нь таамаглал, төсөөлөл байдлаар хэлцэгдэж байгаа юм.
Гэхдээ судасны хананаас авсан эдүүд дээр хийсэн болон өөр хэлбэрийн (in vitro, in vivo гэх мэт) олон тооны судалгаанууд нь эдгээр таамаглалуудыг нэг зүгт хөтлөх боломжийг олгож байна. Атеросклерозын эхний бичил хэмжээний гэмтэл нь жижиг хэмжээний өөх тосны хэсгүүдийн хуримтлал бөгөөд холестерол болон ханасан өөх тос ихтэй хоол идсэнээс үүдэлтэй байж болох юм. Эдгээр липопротейний бүтцийн хэсгүүд нь артерийн интимагийн протеогликантай холбогдож хуримтлагддаг.
Нарийвчилсан судалгаагаар липопротейн нь протеогликантай холбогдсоноор исэлдэх болон бусад химийн хувиралд ордог бөгөөд энэ нь атеросклерозын эмгэг жамд чухал ач холбогдолтой юм. Бусад судалгаануудад мэдээлж байгаагаар эндотелийн нэвчимтгий чанар ихэссэн хэсгүүдэд бага нягттай липопротейн (LDL) нэвчиж байгааг мэдээлсэн.12-15 Үүсэн бий болж буй атеромагийн исэлдэх урвал нь судасны эсүүдийн судасны эсүүдээс ялгарч буй никотинамид аденин динуклеотид, никотинамид аденин динуклеотид фосфат-хамааралт оксидаза болон нэвчиж орсон лейкоцитээс ялгарах липооксигеназаар нөхцөлдөн үүсдэг байна. Нэмж хэлэхэд хэт исэлдэлт, агрегаци, сфингомиелиназа-хамааралт ферментийн идэвхжил болон сахаржих процессууд нь интима дээрх бага нягттай липопротейныг хувиргадаг байна.16
Лейкоцит цуглах: Атерома үүсэж эхлэх хоёрдогч морфологийн тодорхойлогдож болох өөрчлөлт нь лейкоцитийн цугларалт юм. Хэвийн эндотел эс нь лейкоциттэй адгезийн харилцан үйлчлэлд ордоггүй тэсвэртэй байдаг.4,7,16 Тэр ч бүү хэл, үрэвсэл болсон эдүүдэд лейкоцит нь капиллярын дараах венулуудад цугладагаас артерид хэзээ ч нүүдэллэн хуримтлагддаггүй байна.
Хэдий тийм боловч, гиперхолестеринеми үүсэх эхэн үед лейкоцит нь артерийн эндотел эстэй холбогдох бөгөөд эндотел эс хоорондын завсраар хуурамч хөл гарган нэвтрэн орж интимад цуглаж, тэр хэсэгт хуримтлагдсан илүүдэл липидүүдийг залгин хуримтлуулж хөөмөл эс болон хувирдаг (Зураг 2). Эндотель эсийн гадаргууд илрэх лейкоцитийн адгезив молекул нь эндотел эстэй Т эс болон моноцит эс холбогдохыг зохицуулдаг. Ялангуяа, иммуноглобулины дээд бүлд хамаарах адгезив молекулууд нь эрт үеийн атерогенезэд ихээхэн анхаарал татаж байгаа молекулууд бөгөөд учир нь эдгээр молекулууд нь лейкоцитийн гадаргууд илчлэгддэг интегринтэй (very late antigen-4) холбогддог бөгөөд улмаар үүсэн байгаа атеромад моноцит болон Т эсийг хуримтлуулж өгөх үүргийг гүйцэтгэнэ.
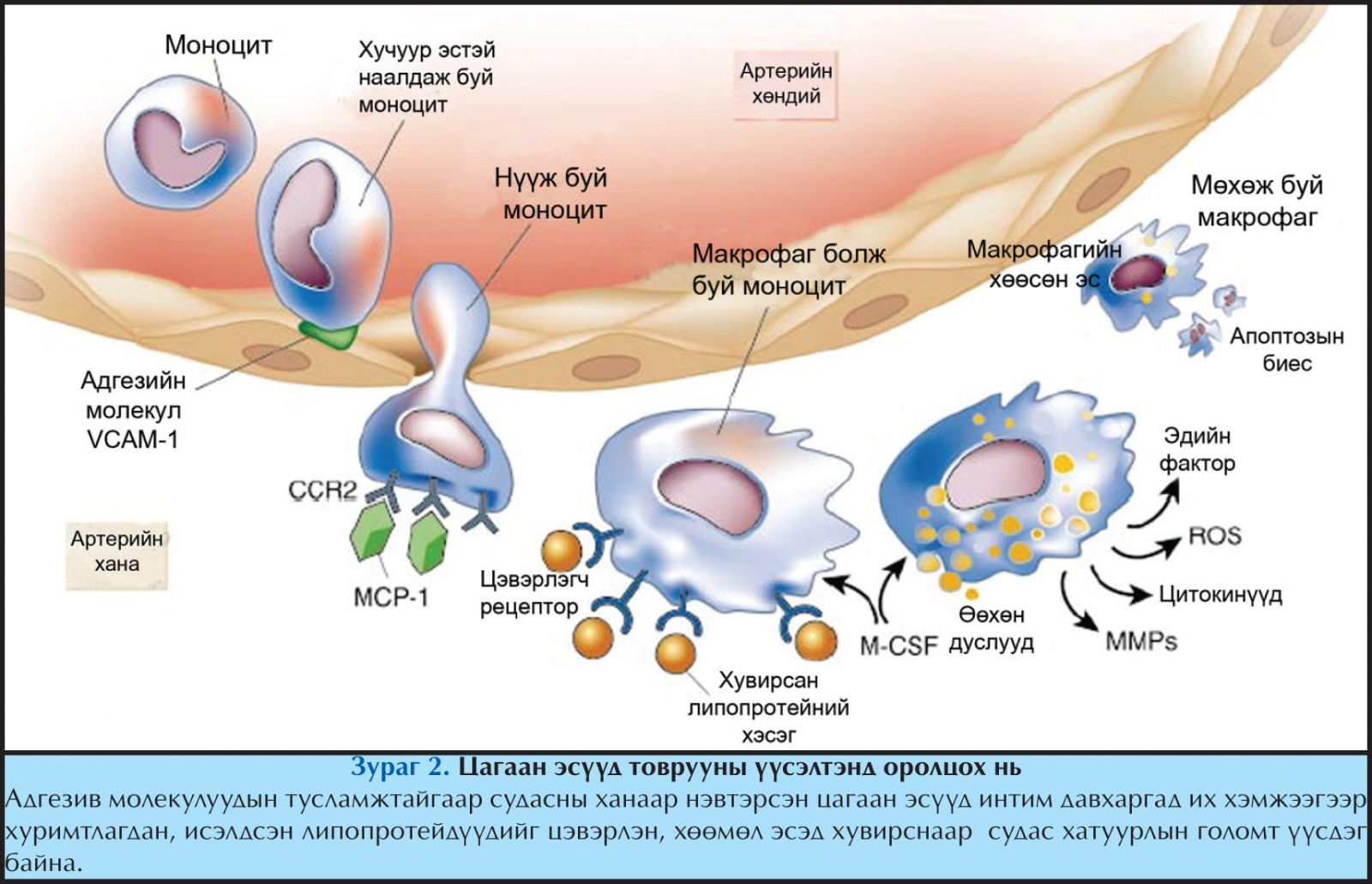
Эндотель эстэй холбогдсон тохиолдолд лейкоцит нь эндотелийн завсраар нэвтэрч орох дохиог авдаг бөгөөд артерийн ханаар нэвтэрч ордог. Үүнд лейкоцитийн чиглэлийг тодорхойлогч хемоатрактант цитокин буюу хемокинүүд оролцдог. Эрт үеийн атеромад мононуклеар эсүүдийг цуглуулагч 2 төрлийн хемокинүүд ихээхэн сонирхол татаж байна. Үүний нэг болох monocyte chemoattractant protein-1 (MCP-1) нь эндотел эсээс исэлдсэн липопротейн болон бусад цочроогчийн үйлчлэлээр ялгардаг. Гиперлипидеми нь генетикийн суурьтай боловч MCP-1 болон түүний рецепторыг байхгүй (-/- MCP-1) болгож генетикийн хувьд өөрчилсөн хулгана дээр хийсэн судалгааны үр дүнгээс харахад байхад МСP-1 байхгүй тохиолдолд атерома үүсэх үйл явц нь удааширч байсан байна.16,17
Атеросклерозын товруу нь ихэвчлэн судасны салааны бифуркаци үүсгэсэн хэсгийн проксимал талд байрладаг нь атеросклероз үүсэлтийн гидродинамик онолын үндэс болдог.
Салаа байдаггүй артериудад атеросклероз үүсдэггүй (жиш: arterius internal mammary болон ar.radialis) байна. Хэсэг газрын сарнисан урсгал нь тухайн хэсэг газарт гэмтэл учруулж тэр нь эрт үеийн атерогенезийн хөгжлийн эхлэл болдог. Нөгөө талаар ламинар урсгал нь атеросклерозын хөгжлийг дэмждэггүй, харин эсрэгээр антиатероген (судас хамгаалах) шинж чанартай бөгөөд In vitro судалгааны үр дүн нь ламинар урсгал нь атеросклерозоос хамгаалах үйлчилгээтэй супероксиддисмутаза, нитрик оксид синтетаза зэрэг генүүдийг идэвхжүүлж байдгийг тодорхойлсон байна.18 Супероксид дисмутаза нь хэт исэлдлийн урвалыг саатуулж байдаг бол, эндотелийн нитрик оксид синтетаза (eNOS) нь дотоод гаралтай судас тэлэгч NO-г үйлдвэрлэж байдаг ба NO нь VCAM-1-ийн үүслийг саатуулснаар үрэвслийн эсрэг үйлдлийг үзүүлдэг.19,20
Мөн сүүлийн үеэс зөвхөн тодорхой артериудын тодорхой хэсэг судас хатууралд өртөөд байгаа талаар тайлбар өгч магадгүй зарим ойлголтуудыг судлаачид судалж байна. Тухайлбал: Гөлгөр булчингийн эсүүд нь эмбриологийн ялгаатай орчноос үүсэн хөгждөг байна. Жишээлбэл, биеийн дээд хэсгийн артериудын гөлгөр булчин нь нейроэктодермээс гаралтай бол доод хэсэг нь мезодермээс гаралтай.
Харин титэм судасны артерийн гөлгөр булчин нь Anlage гэдэг эпикардийн үүдэл эрхтэнээс гаралтай.16 Хэдийгээр энэ нь судас хатууралтай хэрхэн холбоотойг одоогоор бүрэн тодорхойлоогүй хэдий ч, магадгүй атеросклерозын цаг хугацаа болон байршлын талаарх зарим ойлгомжгүй зүйлсийг тайлбарлахад бидэнд тусалж ч магадгүй юм.
Эсийн доторхи липидийн хуримтлал, хөөмөл эсийн үүсэх нь:
Артерийн интимад цугласан моноцит нь липидийг залгиж хөөмөл эс болон хувирдаг. Ихэнхи эсүүд нь LDL-ийн рецепторыг экспресслэдэг боловч энэ рецептор нь хөөмөл эс үүсэлттэй хамааралгүй юм. Энэ нь LDL-рецепторын үйл ажиллагаа алдагдсан өвчтөнүүдэд (гэр бүлийн гиперхолестеринеми-гийн гомозигот) мөн хөөмөл эс үүсэж байсан баримтаар батлагддаг.21-23 LDL рецептор нь хөөмөл эс үүсэлтэнд оролцдоггүй бөгөөд энэ нь түүний холестеролоор зохицуулагддаг нарийн зохицуулгаар тайлбарлагддаг.
Учир нь эс нь өөрийн метаболизмд шаардлагатай хангалттай хэмжээний холестеролыг авсныхаа дараагаар өөрийн гадаргуу дээрх LDL рецепторынхоо хэмжээг эсийн дотоод нарийн зохицуулгын тусламжтайгаар багасгах буюу түүний нийлэгжихийг нь зогсоодог. LDL рецепторын оронд сэг түүгч рецептор (scavenger рецептор) нь липидийн залгилтанд оролцож, хөөмөл эсийн бүрэлдэлтэнд мөн оролцдог.23 Хамгийн их хэмжээгээр судлагдсан нь сэг түүгч рецепторын А (SRA) бүл бөгөөд судлаачдын анхаарлыг ихээр татаж байгаа юм. Энэ гадаргуугийн молекул нь хэвийн LDL-ийг залгихаасаа илүү өөрчлөгдөж, хувирсан липидүүдийг залгидаг.
Судас хатуурлын модел хулгана дээр хийсэн туршилтаар сэг түүгч рецепторын үйл ажиллагааг үгүй болгоход хөөмөл эсийн бүрэлдэлт нь SRA хэвийн хулганаас бага байгааг нотолсон. Мөн өөрчлөгдсөн липопротейнтэй холбогдох чадвартай бусад рецепторуудаас жишээ татвал CD36 болон макросиалиныг дурьдаж болно.24 Макросиалин рецептор нь ялангуяа LDL-ийн исэлдсэн хэлбэртэй холбогдох чадвар өндөр байдаг. Нэгэнт макрофаг интимад ирж хөөмөл эс болон хувирсан бол хуваагдаж эхэлдэг. Атеросклерозын товруу дахь макрофаг эсийн хуваагдлыг өдөөгч хүчин зүйл нь macrophage colony stimulating factor (M-CSF) юм. M-CSF үгүй болгосон хулганад өөхөн зурвас үүсэх явц дарангуйлагдаж байсан. Макрофагийн митоген хуваагдалд оролцдог бусад хүчин зүйлүүдэд интерлейкин-3, гранулоцит-макрофагийн клоныг идэвхжүүлэгч нар ордог.23,24
Гөлгөр булчингийн эсийн миграци болон пролифераци:
Атеромагийн хөгжлийн эхэн үеийн голомтод эндотел эсийн үйл ажиллагаа алдагдсанаар лейкоцитүүдийн хуримтлал болдог ба цаашид атерома бүрэлдэх хөгжлийн явцад гөлгөр булчингийн эсүүд оролцсон илүү нарийн бүтэц бүхий товруу бүрэлдэн тогтдог.4 Хэвийн артерийн судасны дунд давхаргад байрлах гөлгөр булчингийн эсүүд нь судасны дотор давхаргаас тусдаа оршдог. Хэдийгээр цөөн тооны гөлгөр булчингийн эсүүд нь амьдралын эрт үед артерийн интима давхарга руу нэвтрэн байрладаг бол атерома үүсэх үйл явцын үед гөлгөр булчингийн эсүүд нь интима руу их хэмжээгээр нүүн шилждэг.17 Гөлгөр булчингийн эсүүдийг нүүн шилжүүлэхэд хемоатрактант молекулууд оролцдог. Эдгээр молекулуудын сонгомол жишээ нь ялтас хамааралт өсөлтийн хүчин зүйл (PDGF) бөгөөд идэвхижсэн макрофагаас ялгарч, судас хатуурлын голомтод хэт ихээр үүсдэг байна.
Атеросклероз болсон интима дахь гөлгөр булчингийн эсүүд нь эсийн хуваагдлын улмаас олширдог.23 Хүний атеросклероз болсон хэсэг дэх гөлгөр булчингийн эсийн хуваагдлын түвшин нь 1%-с бага байдаг. Хэдий тийм боловч хэдэн арван жил өнгөрөхийн хэрээр гөлгөр булчингийн эсүүд олширч, хуваагдсаар судас хатуурлын товруунд улам ихээр хуримтлагдсаар л байдаг.22-25
Атерогенезийн явц дахь гөлгөр булчингийн эсийн үхэл:
Гөлгөр булчингийн эсүүд репликаци болохын хажуугаар атеромагийн бүрэлдэхүүнд оролцдог эсүүдийн үхэл нь судас хатуурлын товрууны хүндрэлд тодорхой үүргийг гүйцэтгэн оролцоно.
Бүрэн хөгжсөн атеросклерозын товруунд гөлгөр булчингийн эсүүдэд бөөмийн ДНХ нь хэсэг хэсэг болон салах замаар, өөрөөр хэлбэл эсийн програмчлагдсан үхлийн (апоптоз) замаар дээрх эсүүд үхдэг. Судас хатуурлын товруунд ихээр байгаа үрэвслийн цитокинуудын үйлчлэлийн хариуд апоптоз нь үүсэж байж магадгүй бөгөөд энэхүү урвалд голцуу уусамтгай цитокинууд оролцдог. Атерома дахь Т эсүүд нь зарим гөлгөр булчингийн эсүүдийг зайлуулахад оролцдог ба гадаргуу дээрээ Fas лигандыг ялгаруулснаар гөлгөр булчингийн эсийн Fas лигандийг холбон, зарим цитокины хамтаар гөлгөр булчингийн эсийн апоптозыг өдөөдөг. Улмаар гөлгөр булчингийн эсийн репликаци болон апоптозын харьцааны үр дүнд судас хатуурлын товруунд их хэмжээгээр гөлгөр булчингийн эсүүд хуримтлагддаг. Эсийн болон молекул биологийн судалгаанууд нь эдгээр үйл явцыг үүсгэх хэд хэдэн кандидат генүүдийг нээгээд байгаа билээ.16,26
Артерийн эсийн гаднах матрикс
Атеросклерозын товруун дахь эсүүдээс илүүтэйгээр эсийн гаднах матриксууд нь судас хатуурлын товруунд их хэмжээтэйгээр агуулагдаж, бүтцийн бүрэлдэхүүнд оролцдог.
Иймээс эсийн гаднах бүтцүүд нь судас хатуурлын эмгэгт тодорхой үүргийг гүйцэтгэх нь ойлгомжтой. Атерома дахь матриксийн макромолекулууд нь ихэвчлэн версикан, бигликан, агрекан болон декорин зэрэг завсрын эдийн коллагенүүд (I болон III төрөл) болон протеогликануудаас тогтдог. Эластин ширхэгүүд нь мөн атеросклерозын товруунд ихээр хуримтлагддаг. Судасны гөлгөр булчингийн эсүүд нь судас хөгжих болон засварлах үед эдгээр матриксийн молекулуудыг нийлэгжүүлдэг байна.12
Гөлгөр булчингийн эсээс коллаген нийлэгжих дохиог ялтас эсийн мөхлөгт агуулагддагаас гадна үрэвслийн голомт дох бусад олон эсээс үүсдэг PDGF болон TGF-β нар өгдөг. Гөлгөр булчингийн эсүүдтэй адил эсийн гаднах матриксийн хуримтлал нь тэнцвэртэй хэмжээндээ байдаг. Эсийн гаднах матриксийн нийлэгжилтийн хажуугаар, матриксийн металлопротейназа (MMP) хэмээгч уургууд тэдгээрийг задлан тэнцвэрт байдлыг зохицуулж байдаг.12 Эсийн гаднах матриксын молекулын тэнцвэрийн алдагдал нь гөлгөр булчингийн эсүүд дунд давхаргаас интимагийн зүг нүүн шилжихэд гол үүргийг гүйцэтгэдэг. Гэмтсэн артерид метталлопротейназа-гийн ингибиторын (TIMP) их хэмжээгээр үүссэнтэй холбоотой интима уруу гөлгөр булчингийн эсийн нүүдэллэн хуримтлагдах нь саатдаг.4
Товрууны ангиогенез:
Гөлгөр булчингийн эс нь ганцаараа олширч нүүж атеросклерозын товрууг үүсгэхэд оролцдоггүй бөгөөд мөн эндотел эс нүүн хуваагдаж шинэ судаснууд үүсгэн улмаар товруун дотор жижиг цусан хангамжийг бий болдог. Эдгээр судаснуудыг харахын тулд ихэвчлэн өвөрмөц будаг хэрэгтэй болдог. Эдгээр бичил судаснууд нь судас хатуурлын товрууны хэсэгт их хэмжээгээр үүссэн ангиогеник пептидүүдийн үйлчлэлийн үр дүнд бүрэлдэн тогтдог.
Эдгээр ангиогенезийн хүчин зүйлүүдэд фибробластын хүчиллэг болон суурилаг өсөлтийн хүчин зүйлүүд (human BGFs I and II), судасны эндотелийн өсөлтийн хүчин зүйл (VEGF) болон онкостатин М ордог.4,8,9,12 Эдгээр товруун доторхи жижиг судаснууд нь нэлээн чухал үйл ажиллагааны ач холбогдолтой юм. Жишээлбэл, товруун доторхи их хэмжээгээр үүссэн жижиг судаснууд нь лейкоцитийн нэвтрэх болон гадагшлахад хангалттай хэмжээний том талбайг үүсгэж өгдөг.
Мөн том судасны эндотелтэй харьцуулахад эдгээр бичил судсууд нь VCAM-1 зэрэг мононуклеар лейкоцит өвөрмөц адгезив молекулуудыг илүү их хэмжээгээр гадаргуу дээрээ үүсгэдэг. Мөн түүнчлэн энэ бичил судасжилт нь товрууг өсөн хөгжих болон оршин тогтноход шаардлагатай хүчилтөрөгч, тэжээлийн бодисуудаар хангах үүргийг гүйцэтгэнэ.
Шинээр үүссэн судаснууд нь хөвсгөр байдаг бөгөөөд урагдахдаа амархан байдгаас чихрийн шижний үед нүдний торлог бүрхэвчийн судаснуудад үүсдэгтэй адилаар дээрх бичил судаснуудад цус харвалт, тромбоз үүсэх нь нийтлэг.4 Улмаар энэ үйл явц нь тухайн хэсэгт маш түргэн хугацаанд гөлгөр булчингийн эсүүд болон эсийн гаднах матриксууд их хэмжээгээр үүсэн бүрэлдэх шалтгаан болж өгдөг.
Товруу минералжих:
Товруу нь хөгжихийнхөө явцад байнга кальцжиж байдаг. Вирхов болон Рокитански хоёр микроскоп ажиглалтынхаа үндсэн дээр товруунд ясжих процесс явагдаж байгааг тэмдэглэсэн байдаг. Харин орчин үед минералжих процессын механизмийг илүү нарийнаар тайлбарлах болсон.
Гөлгөр булчингийн эсийн зарим субпопуляци нь TGF-β-гийн гомологууд, ясны морфогенетик уураг зэрэг цитокинуудыг их хэмжээгээр ялгаруулж кальцжилтыг дэмждэг. Атеросклерозын товруу нь гаммакарбоксил глутамины хүчилтэй уургуудыг агуулдаг бөгөөд энэ нь кальцийн секвестержилтийг дэмжин минералжих явцыг хурдасгадаг.
Артерийн нарийсал (стеноз):
Атеросклерозын товруу үүсэх болон хэлбэржих олон жилийн туршид уг хүндээ ямар нэгэн клиникийн шинж тэмдэг өгдөггүй. Товруу аажимдаа томорсоор артерийн судсаар урсаж байгаа цусны урсгалд саад учруулж эхэлдэг. Товруу томорсоор цусны урсгалыг 60%-иас их хэмжээгээр саатуулж эхэлсэн тохиолдолд клиникийн шинж тэмдэг өгч эхэлдэг. Титэм судасны хувьд бөглөрөлтийн гол шинж тэмдэг нь цээжээр өвдөх шинж (стенокарди) юм. Тиймээс уг шинж тэмдэг үүсэхээс олон арван жилийн өмнө атеросклероз үүссэн байдаг нь тодорхой.
Сүүлийн хэдэн жилийн явцад хийсэн эмнэл зүйн хэд хэдэн судалгаануудаар ихэнхи миокардын инфаркт нь цусны урсгалын дээд хэмжээний бөглөрөлтөөс бус буюу өөрөөр хэлбэл судас хатуурлын шалтгаант нарийсал нь цусны урсгалыг саатуулах хэмжээнд хүртэл томроогүй байхад үүссэн байна. Жишээлбэл: миокардийн инфаркт болохоос өмнө титэм судасны артерографи хийлгэсэн хүнд стенозын зэрэг нь 50%-с бага байсан байна.6
Ийм төрлийн хэд хэдэн судалгааны нэгдсэн дүнгээр нийт инфаркт болсон хүмүүсийн 15 орчим хувьд нь л инфарктаас өмнөх ангиографиар 60%-иас дээш стенозтой гэсэн онош тавигдсан байсан байна. Интимагийн прогрессив зузааралтыг эс тооцвол, тромбоз болон атеросклерозын товруу тасрах явц нь ихэнхи тогтворгүй цээжээр өвдөлт болон цочмог миокардийн инфарктын шалтгаан болж байгааг тооцоолж үзэх хэрэгтэй. Гэхдээ хэдийгээр цөөн тохиолддог ч хэт нарийсал нь судас хатуурлын хөндийг бөглөөгүй товруунаас илүүгээр цочмог инфаркт үүсгэдгийг үгүйсгэж болохгүй юм.
Товрууны урагдал ба тромбоз:
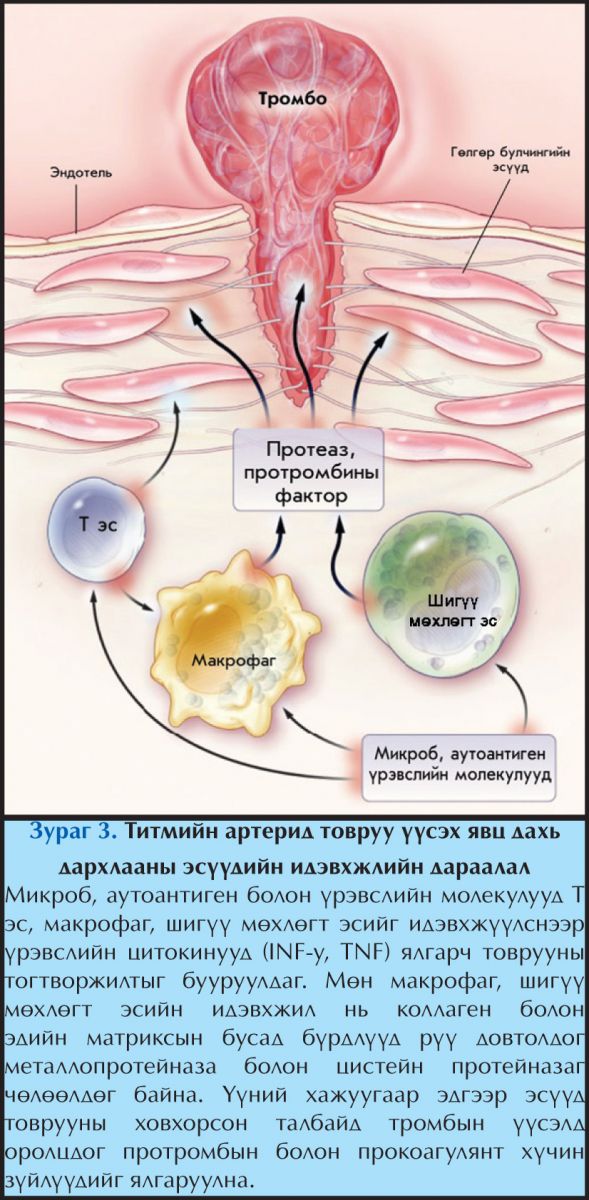
Судас хатуурлын архаг байдлаас цочмог хам шинж үүсэн, титэм судасны дутагдал үүсэх эмгэг жамын тайлбарт тромбоз нь маш чухал хүчин зүйл болох нь нэгэнт тодорхой болоод байна. Цочмог тромбозын шалтгаан нь атеросклерозын товруу тасрах юм. Атеросклерозын товруу тасрахдаа үндсэн 2 механизмаар явагдана.4 Эхний механизм нь тромбозын шалтгаанаар цочмог дутагдал үүсэх эмгэгийн гуравны хоёрыг хамрах бөгөөд товрууны фиброзон бүрхүүл урагдах үйл явц юм. Хоёр дахь механизм нь интимагийн гадаргуугийн шархлаа бөгөөд уг гадаргуугийн урагдлын шалтгаанаас үүссэн миокардийн инфаркт нь эмэгтэйчүүдэд эрэгтэйчүүдээсээ илүү ихээр тохиолддог болох нь тогтоогдсон байна.
Товрууны фиброзон бүрхүүл нь цусны урсгалын цохих хүч болон фиброзон бүрхүүлийн тэсвэртэй орших хүчний тэнцвэрт байдалд оршиж байдаг бөгөөд энэ тэнцвэр алдагдсан тохиолдолд товрууны урагдал болдог. Завсрын эдийн коллаген ширхгүүд нь фиброзон бүрхүүлийн тэсвэртэй байдлыг хангах гол элемент болдог ба коллагены бодисийн солилцоотой холбоотойгоор товруу урагдах нөхцөл бүрэлдэж болдог байна. Гөлгөр булчингийн эсээс ялгарч байгаа коллагены синтезийг бууруулагч хүчин зүйлүүд нь товрууны фиброзон бүрхүүлийн нөхөх, засварлах үйл явцыг алдагдуулснаар товрууны урагдалд оролцдог байж болох юм (Зураг 3). Жишээлбэл: Т эс хамааралт цитокин интерферон гамма (IFγ) нь гөлгөр булчингийн эсийн коллаген нийлэгшүүлэхийг саатуулж өгдөг.
Нөгөө талаас ялтаснаас ялгардаг TGFb болон PDGF нь гөлгөр булчингийн эсийн коллагены синтезийг ихэсгэж фиброзон бүрхүүл тогтох процессыг дэмжиж өгдөг.4,5 Макрофагууд матриксын металлопротейназууд болон эластолитик катепсинуудыг ялгаруулснаар артерийн эсийн гаднах матриксийн коллаген болон эластиний хэмжээг багасгадаг. Ингэснээр дээрх ферментүүд болон бусад үйлчлэлийн үр дүнд нимгэрээд байгаа фиброзон бүрхүүлийг нөхөх материалын дутагдал үүсэж, улмаар цочмог тромбозын хүндрэлийн шалтгаант миокардийн инфаркт үүсдэг. Өөр нэгэн таамаглал бол харьцангуйгаар гөлгөр булчингийн эсүүд багассан хэсэг газрын фиброзон бүрхүүл урагддаг гэсэн онол юм.
Үрэвслийн медиаторууд болон Т лимфоцит эс нь гөлгөр булчингийн эсийг эсийн програмчилсан үхэлд хүргэснээр хэсэг газар гөлгөр булчингийн эсүүд байхгүй болж улмаар тэр хэсгийн фиброзон бүрхүүл нь урагддаг. Үүний учир нь тэдгээр эсүүд нь коллагеныг шинээр бий болгох үндсэн эх сурвалж болдог бөгөөд уг эсүүд багассанаар эсийн гаднах матриксийн нөхөн сэргээлт алдагдаж фиброзон бүрхүүл нь нимгэрдэг байна. Мэдээж дараа нь юу болохыг та мэдэж байгаа.
2. Elisabeth Dernbach, Carmen Urbich, Ralf P.Brandes, Wolf K.Hofmann, Andreas M.Zeiher, and Stefanie Dimmeler. Antioxidative stress-associated genes in circulating progenitor cells: evidence for enhanced resistance against oxidative stress. Hemostas Tromb Vasc Biol. 2004; 104:3591-3597
3. P.M.Humpert, H.Eichler, A.Lammert, H.P.Hammes, P.P Nawroth and A.Bierhaus. Adult Vascular progenitor cells and tissue regeneration in metabolic syndrome. VASA.2005; 34:73-80
4. Libby P.: 2005. The pathogenesis of atherosclerosis. Harrison’s (16th ed.) Internal Medicine. 1425-1430.
5. Brevetti G, Silvestro A, Di Giacomo S, et al.:2003. Endothelial dysfunction in peripheral arterial disease is related to increase in plasma markers of inflammation and severity of peripheral circulatory impairment but not to classic risk factors and atherosclerotic burden. J Vasc Surg 38:374–379.
6. Van Leiden HA, Dekker JM, Moll AC, Nijpels G, Heine RJ, Bouter LM, et al: 2002. Blood pressure, lipids, and obesity are associated with retinopathy: the hoorn study. Diabetes Care 25:1320-1325
7. Holmlund A, Hulthe J, Millgard J, et al.: 2002. Soluble intercellular adhesion molecule-1 is related to endothelial vasodilatory function in healthy individuals. Atherosclerosis 165:271–276.
8. Sinisalo J, Paronen J, Mattila KJ, et al.: 2000. Relation of inflammation to vascular function in patients with coronary heart disease. Atherosclerosis 149:403–411.
9. Markers of Inflammation and Rapid Coronary Artery Disease Progression in Patients With Stable Angina Pectoris.: 2004 Emmanouil Zouridakis, Pablo Avanzas, Ramуn Arroyo-Espliguero, Salim Fredericks, Juan Carlos Kaski. Circulation 110:1747-1753
10. Anderson JL: 2005. Infection, antibiotics, and atherothrombosis - end of the road or new beginnings? N Engl J Med 352:1706–1709.
11. Lale AFRASYAP and Guler OZTURK.: 2004. NO Level and Endothelial NO Synthase Gene Polymorphism (Glu298Asp) in the Patients with Coronary Artery Disease from the Turkish Population. Acta Biochimica et Biophysica Sinica 36:661–666
12. Brevetti G, Martone VD, De Cristofaro T, et al.: 2001. High levels of adhesion molecules are associated with impaired endothelium-dependent vasodilation in patients with peripheral arterial disease. Thromb Haemost 85:63–66.
13. Stocker R, Keaney JF: 2004. The role of oxidative modifications in atherosclerosis. Physiol Rev 84:1381–1478. Silvia Nistri, Luca Mazzetti, Paola Failli and Daniele Bani.: 2002. High-Yield Method for Isolation and Culture of Endothelial Cells from Rat Coronary Blood Vessels Suitable for Analysis of Intracellular Calcium and Nitric Oxide Biosynthetic Pathways. Biol. Proced. 4:32-37.
14. Rong-Ze Yang, Mi-Jeong Lee, Hong Hu, Toni I. Pollin, Alice S. Ryan, Barbara J. Nicklas, Soren Snitker, Richard B. Horenstein, Kristen Hull, Nelson H. Goldberg, Andrew P. Goldberg, Alan R. Shuldiner, Susan K. Fried, Da-Wei Gong.: 2006. Acute-Phase Serum Amyloid A: An Inflammatory Adipokine and Potential Link between Obesity and Its Metabolic Complications. Journal Plos Medicine. 3;287:0001-0011.
15. R. Deepa, K. Arvind and V. Mohan: 2002. Diabetes and risk factors for coronary artery disease. Diabetes 83:1497-1505
16. Avogaro A, de Kreutzenberg SV: 2005. Mechanisms of endothelial dysfunction in obesity. Clin Chim Acta 360:9-26
17. Nikos Werner, Georg Nickenig: 2006. Influence of Cardiovascular Risk Factors on Endothelial Progenitor Cells. Limitations for Therapy? Arteriosclerosis, Trombosis, and Vascular Biology 26:1005-1011
18. Cunningham Kristopher S and Gotleb Avrum I. The role of shear stress in the pathogenesis of atherosclerosis. Laboratory Investigation. 2005;85: 9-23
19. Philip W. Shaul and Chieko Mineo: 2004. HDL action on the vascular wall: is the answer NO? J. Clin. Invest. 113:509-513.
20. Bulent Sozmen et al; 1998. Plasma Antioxidant Status and Nitrate Levels in Patients With Hypertension and Coronary Heart Disease. Tr J Medical Sciences 28:525-531
21. Kenchaiah S, Evans JC, Levy D, Wilson PW, Benjamin EJ, Larson MG, et al: 2002. Obesity and the risk of heart failure. N Engl J Med 347:305-313
22. Robert Wolk, Arjun Deb, Noel M. Caplice, Virend K.Somers: 2005. Leptin receptor and functional effects of leptin in human endothelial progenitor cells. Atherosclerosis 183:131-139
23. Imanishi T, Hano T, Matsuo Y and Nishio I: 2003. Oxidized low-density lipoprotein inhibits vascular endothelial growth factor-induced endothelial progenitor cell differentiation. Clinical and Experimental Pharmacology and Physiology 30:665-670
24. Lars Berglund: 2006. Lipoprotein Metabolism: A Well-Tried Tool to Characterize Dyslipidemic Mechanisms. Arterioscler Thromb Vasc Biol 26: 1201 – 1203
25. Aruna D. Pradhan, Nader Rifai and Paul M.Ridker2001. Soluble Intercellular Adhesion Molecule-1, Soluble Vascular Adhesion Molecule-1, and the Development of Symptomatic Peripheral Arterial Disease in Men. Circulation;104:1336-1342
26. Patrick H Dessein, Barry I Joffe, and Sham Singh: 2005. Biomarkers of endothelial dysfunction, cardiovascular risk factors and atherosclerosis in rheumatoid arthritis. Arthritis Res Ther 7(3): R634–R643




