1 Био-АнагаахынСургууль, ЭМШУИС
2Хими, Хими Инженерчлэлийн Сургууль, ЭМШУИС
Энэхүү ажлын зорилго нь ион солилцооны болон гель фильтрацийн хроматографийн аргыг хослуулсан цөөн шатлалт, харьцангуй хямд аргаар үхрийн сүүнээс β-лактоглобулинийг гарган авах аргыг танилцуулахд оршино. Казейн тунадасжуулж, тослогоос нь салгасан дээжийг сул анион солилцогч орчин болох DEAE-Sepharose FF баганад шахна. Ажлын буфер нь Трис-HCl, градиентийг мөн буферт NaCl-ийн шугаман градиент явуулсан. Дараагийн шатыг Sephadex G-75 орчин бүхий хроматографийн баганад өмнөх шатны β-лактоглобулин бүхий концентрацжуулсан дээжийг шахаж, гарсан үр дүнг SDS-PAGE арга ашиглан шалгасан.
Танилцуулга
Үхрийн сүү нь биологийн идэвхитуураг болон үл орлогдох амин хүчлийн хамгийн түгээмэл эх үүсвэр юм. Сүүний тэжээлийн ач холбогдлын талаар хангалттай олон судалгаа шинжилгээний тойм өгүүллүүд байдаг хэдий чхүмүүсийнсүүний уургандхэт мэдрэгших нь нэмэгдсээр байна. Харшлын урвалын механизмыг илүү сайн ойлгохын тулд аллергений молекул шинж чанарыг судлах шаардлагатай болдог. Олон судалгаанууд үхрийн сүүнд 20 гаруй тооны харшил үүсгэдэг уургууд байдгийг тогтоогоод байна. Сүүнд байдаг хамгийн их аллерген шинжтэй уураг бол β-лактоглобулин бөгөөд сүүний харшилтай хүмүүсийн 82% нь уг уурагт мэдрэгшилтэй байдаг байна [1].Үүнийгилрүүлэхийн тулд антиген цэвэр хэлбэрээрээ шаардлагатай [2].
Мөн түүнчилэн аллергенийн цэврээр ялган авснаар клиникийн судлаачдад фермент холбоот урвалын оношлогооны техник ашиглан өвөрмөц эсрэг биеийг тодорхойлох боломжтой болгодог [3]. β-лактоглобулин нь үхрийн шар сүүний уургийн ойролцоогоор 50%-ийг эзэлдэг шар сүүний гол уургуудын нэг юм [4]. Үхрийн сүүний β-лактоглобулин нь 162 амин хүчлээс тогтсон (18.3kDa), ижил цэнэгт цэг нь 5.3 байдаг [5].Уг уургийн тэжээлийн болонтехнологийн ач холбогдол илүү сайн судлагдсан байдаг [6-8].
Тунадасжуулах, мембранаар шүүх, өндөр даралтат шингэний хроматограф зэрэг олон техникүүдийг дангаар нь болон хослуулан β-лактоглобулинийг цэврээр ялгадаг [9, 10].Ион солилцооны хроматограф, ялангуяа анион солилцооны хроматографинь шар сүүний үндсэн найрлага болох лактоз, иммуноглобулин G, ийлдсийн албумин, β-лактоглобулин, β-лактоалбуминыг ялган, салгахд хамгийн тохиромжтой техник байдаг [11].
Материал, аргазүй
А. Үхрийн сүүний шар сүүний уургийн фракцийг бэлтгэх
Монгол үхрийн цэвэр сүүг авч 2oC-н хөргөгчиндхадгаландээжбэлтгэхэдашигласан. 10мл сүү авч8000xg эргэлтээр 4оС-т 15 мин центрифугдэхэд дээжний дээд хэсэгт тослог нь ялгарах бөгөөд пипеткээр тослоггүй доод хэсгийг болгоомжтой салгаж авна. Тослоггүйжүүлсэн дээжний казейнийг 1 молийн давсны хүчлийн тусламжтайгаар рН 4.6 болгохд казейн уургийн фракц тунасан ба 8000xg эргэлтийн хурдаар 4оС-ийн хөргөлттэй центрифугээр 10 минут центрифугдэж, тослоггүй, казейнгүй шар сүүний уургийн фракц гарган авна. Дээжийг хэрэглэхээс өмнө бэлтгэн 0.45μm фильтрээр шүүж, Лоурын аргаар нийт хэмжээг тодорхойлсон.
Б. Анион солилцооны хроматографи
DEAE-Sepharose FF (Sigma Aldrich)орчинг ХК 16/20 баганад (Amersham Bioscience) хийн үйлдвэрлэгчийн зааврын дагуу15 мл эзэлхүүнтэй хроматографийн баганыгугсарсан. Бэлэн болсон баганыг Трис-HCl (рН 7.0) буферийн 5 колонкийн эзэлхүүнтэй тэнцэх хэмжээгээр 1мл/мин хурдаар колонкоор гүйлгэж дээж шахахад бэлдсэн. Дээж шахах хурд 1мл/мин ба хроматографийн туршид урсгалын хурд өөрчлөгдөөгүй. Холбогдсан уургуудийг 0.25M, 0.5M, 1M NaCl бүхий Трис-НСl буферээр 3 шатлалт градиентээр салгаж, 3 уургийн фракц цуглуулсан. 280нм-ийг UV шингээлтээр фракцийн ялгаралтыг хянасан.
В. Гель фильтрацийн хроматографи
Зааврын дагуу 90оС-т нэг цагийн турш нэрмэл усанд хөөлгөсөн Sephadex G-75орчинг ХК 16/20 баганад (Amersham Bioscience)хийн үйлдвэрлэгчийн зааврын дагууугсарч 30мл эзэлхүүнтэй хроматографийн багана угсарсан. Бэлэн болсон баганыг Трис-HCl (рН 7.0) буферийг 5 баганы эзэлхүүнтэй тэнцэх эзэлхүүнтэй буфер гүйлгэж бэлтгэнэ. Гель фильтрацийн хроматографид хэрэглэгдэх дээжийн эзэлхүүн 0.25мл, урсгалын хурд 0.5мл/мин байна.
Г. SDS-PAGE
SDS-PAGE-ийн аргаар уургийн цэвэршилтийг шалгахдаа давхар хөргүүртэй, P8DS электрофорезийн аппарат ашиглан Лаеммлийн аргаар хийж, гүйцэтгэсэн. 12%-ийн ялгах гельд 40mA-ийн гүйдлийн хүчээр 3 цагийн турш явуулсан. Уургийн фракцыг дээжний буферт уусган 96оС-т 10 минутын турш буцалган гелрүү 5μl –ийг хийсэн. Гелийг Кумас Бриллиант Хөх R250 –аар будаж уургийн фракцуудын бага молекулт жингийн маркертай (Sigma Aldrich) харьцуулан дүгнэсэн.
Үр дүн, дүгнэлт
А. β-лактоглобулинийг ялгах
Үхрийн шар сүүний уургийн анион солилцогч хроматографийн шаталсан градиентийн үр дүнд 3 үндсэн фракц (Зураг 1) гарсан. α-лактоальбумин болон β-лактоглобулин гэсэн шар сүүний үндсэн уургийн фракцууд болох1 болон 2-р фракц 0.25M NaCl-ийн градиентэд гарсан. Сүүний рН 6.8 байдаг учир бидний хэрэглсэн буфер Трис-HCl (pH 7.0) нь шар сүүний уургуудыг өөрчлөлтөнд оруулахгүй.
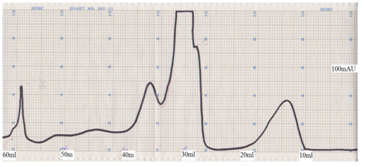
Зураг 1. Anion-exchange chromatography on DEAE-Sepharose FF of bovine whey proteins
α-лактоальбумин (pI 4.93), β-лактоглобулин (pI 5.3)-ий ижил цахилгаан цэнэгт цэгийн хувьд их ялгаа байхгүй учир 1, 2-р фракц сайн салаагүй байна. Тиймээс дараагийн шатанд ион солилцооны хроматографийн техник хэрэглэж болохгүй учир гель фильтрацийн хроматографийн шат тохиромжтой юм.
Б. Гель фильтрацийн хроматографи
β- лактоглобулиний молекул масс
18.4kДа учир гельфильтрацийн орчиноор Sephadex G-75 орчинг сонгосон.
Анион солилцооны хроматографийн 1 болон 2-р фракцаас цуглуулсан 250 мкл дээжийг Sephadex G-75 орчин бүхий баганад 20мМ Трис-HCl pH 7.0 буферээр шахсан. Зураг2-оос өндөрцэвэршилттэй β-лактоглобулиний нэг гол фракц байгаа нь харагдаж байна.
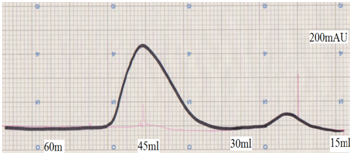
Зураг 2. DEAE-Sepharose FF хроматографийн шатны фракц 1-ийг Sephadex G-75 хроматографи явуулсан дүн
Энэ шатнаас гарсан фракц 2-ийн үүсгэсэн шингээлтийн муруйнсимметрик байдал нь уургийн цэвэршилтийг илэрхийлж байна.
В. SDS-PAGE-ийн дүн
Зураг 3-т фракцийг молекул жингийн маркертай харьцуулан харуулсан байна. Цэвэршүүлсэн β-лактоглобулин нь 18.4кДа молекул масстай гэж үнэлэгдэж байна.
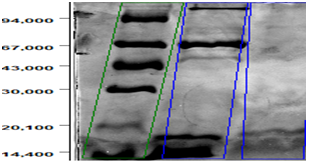
Зураг 3. SDS-PAGE-ийн дүн. 1-р багананд молекул жингийн маркер, 2-р багананд DEAE-Sepharose FF-ийн фракц 1, 3-р багананд Sephadex G-75-ийн фракц 2
Дүгнэлт
Дэлхий дахинд сүүний уурганд хэт мэдрэг байдаг нэмэгдсээр байна [1].Тиймээс сүүнээс харшил төрүүлэгч шинж чанартай уураг болох β-лактоглобулинийг 2 шатлалт хроматографийн аргаар ялган SDS-PAGE-ээр 90%-ээс багагүй цэвэршилттэй 18.4кДа молекул масстай нэг зурвас байгаа нь тодорхойлогдлоо.
2. J. S. Stanley and G. A. Bannon, “Biochemistry of food allergens”, Clin.Rev.Allerg.Immunol, vol. 17, pp. 279-291, 1999.
3. G. Bobe, D. C. Beitz, A. E. Freeman, G. L. Lindberg, “Separation and quantification of bovine milk properties by reversed-phase high performance liquid chromatography”, J.Agric.Food.Chem, vol. 46, pp. 458-469, 1983.
4. C. V. Morr, “Functionality of heated milk proteins in dairy and related foods”,J Dairy Sci, vol. 68, pp. 2773 – 2781, 1985.
5. H. Landmark-Mansson, A. Timgren, G. Alden andM. Paulsson,Intl.Dairy J, vol. 15, pp.111-121, 2005.
6. T.Lefevre and M.Subirade, “Molecular differences in the formation and structure of fine-stranded and particulate beta-lactoglobulingels”,Biopolymers, vol. 54, pp. 578 – 586, 2000.
7. A. Balsand U. Kulozik, “Effectofpre-heatingonthefoamingproperties of whey protein isolate using a membrane foaming apparatus”,Int Dairy J, vol.13, pp. 903 – 908, 2003.
8. V. L. S. Line, G. E. Remondetto and M. Subirade, “Cold gelation of beta-lactoglobulin oil-in-water emulsions”, Food Hydrocolloids,vol. 19, pp. 269–278, 2005.
9. B.Manji, A.Hill, Y.Kakuda, D.M.Irvine,“Rapid separation of milk whey proteins by anion exchange chromatography”,J.Dairy.Sci, vol. 68, pp. 3176-3179, 1985.
10. G.Bordin, F.CordeiroRaposo, B de la Calle and A.R.Rodriguez,“Identification and quantification of major bovine milk proteins by liquid chromatography”,J.Chrom A, vol. 928, pp. 63-76, 2001.
11. S.J. Gerberding and C.H. Byers,“Preparative ion-exchange chromatography of proteins from dairy whey”,J.Chrom A, vol. 808, pp. 141-151, 1998.




